Automatischer Bioaerosolsammler für die kontinuierliche Probenahme

Quelle: Thünen-Institut für Agrarmeteorologie
1 Einleitung
Die messbaren Konzentrationen von Mikroorganismen in der Luft an einem bestimmten Ort unterliegen normalerweise großen Schwankungen, die sich im Bereich von Zehnerpotenzen bewegen können [1 bis 3]. Neben zufälligen Messabweichungen (statistische Unsicherheiten), die sich besonders stark bei niedrigen Konzentrationen im Bereich der Nachweisgrenzen der eingesetzten Probenahmesysteme auswirken, beeinflussen auch meteorologische Faktoren wie Wind, Temperatur, Luftfeuchte, Globalstrahlung und Ozonkonzentration die Menge kultivierbarer Mikroorganismen in der Luft [4 bis 11]. Hinzu kommen anthropogene Einflüsse, hervorgerufen durch Anlagen, in denen beim Umgang mit organischen Materialien in unregelmäßigen Abständen Mikroorganismen in die Luft emittiert werden, wie z. B. Abfallverwertungs- und Kläranlagen, Rückkühlwerke oder auch landwirtschaftliche Betriebe [12]. Messungen zur Ermittlung der durchschnittlichen Emissionen solcher Anlagen oder auch von Hintergrundkonzentration finden aus rein praktischen Gründen meist am Tage, über Zeiträume von wenigen Stunden, statt. So stellen sie immer nur eine Momentaufnahme der aktuellen Situation vor Ort dar. Vor allem nachts aber könnten einerseits die Konzentrationen von Mikroorganismen in der Luft durch die im Allgemeinen geringere Aktivität niedriger ausfallen. Andererseits sind in der Außenluft auch höhere Konzentrationen denkbar, da dann z. B. die für Bakterien schädliche ultraviolette Strahlung fehlt.
Aus diesem Grund haben manche Autoren kontinuierliche Messungen (Tag und Nacht) mithilfe von automatischen Schlitzimpaktoren durchgeführt, z. B. in der Außenluft [13] oder in Tierställen [14; 15]. Bei diesem Probenahmeverfahren werden luftgetragene Partikel direkt auf Nährbodenplatten impaktiert. Dabei bringt jedes Partikel, das vermehrungsfähige Mikroorganismen enthält, unabhängig von deren Anzahl, nur eine zählbare Kolonie hervor. Daher kann mit diesen Systemen nur die Anzahl der kultivierbare Mikroorganismen tragenden Partikel bestimmt werden. Es wurde jedoch gezeigt, dass Partikel je nach Umweltbereich Hunderte einzelner Bakterienzellen enthalten können [1; 16]. Diesbezüglich ist die Probenahme mit Impingern vorteilhaft. Bei diesem Verfahren werden luftgetragene Partikel in einer Flüssigkeit impaktiert und dadurch enthaltene Mikroorganismen vereinzelt. Mit dieser Methode kann theoretisch die Anzahl aller kultivierbaren Mikroorganismenzellen in einer Probe bestimmt werden.
Der Beitrag beschreibt ein System für die kontinuierliche Probenahme von luftgetragenen Mikroorganismen, basierend auf einem Impinger, und präsentiert erste Ergebnisse von Messungen in der Außenluft und in einer Volierenhaltung für Legehennen.
2 Material und Methode
2.1 Probenahmesystem
Der automatische Bioaerosolsammler ist ein kompaktes, modular aufgebautes System, konzipiert für Messungen im Feld, und besteht im Wesentlichen aus fünf Teilen (Bild 1): dem Sammelkopf (A), dem gekühlten Probenbehälter (B) und der Steuereinheit (C) sowie extern einer Vakuumpumpe (D) und einem Behälter für Sammelflüssigkeit (E).
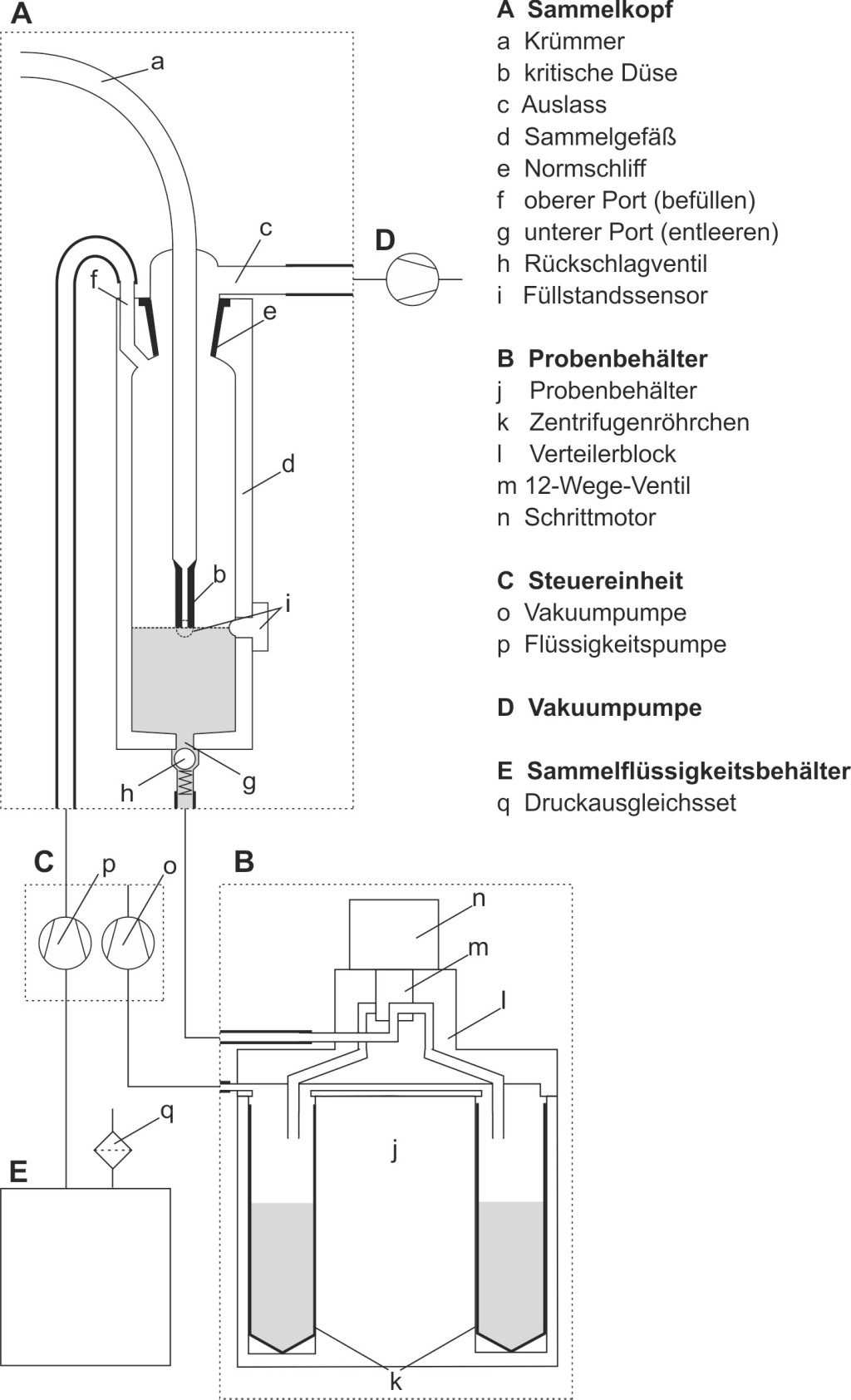
Bild 1. Schematische Darstellung des automatischen Bioaerosolsammlers.
Foto: Thünen-Institut für Agrartechnologie
Der Sammelkopf entspricht in allen kritischen Abmessungen dem standardisierten Immissionsimpinger (AGI-30) [17]. In Vorversuchen zeigten sich keine signifikanten Abweichungen in der Sammeleffizienz. Er besteht aus zwei Teilen: der obere Teil mit gekrümmtem Einlassrohr (a), kritischer Düse (b) und Auslass (c) ist aus Glas gefertigt (Fa. LAT – Labor- und Analysen-Technik, Garbsen). Der untere Teil ist ein Sammelgefäß (d) aus transparentem Polyvinylchlorid (PVC). Beide sind über Normschliff (e) (24/29, DIN 12242) verbunden. Das Sammelgefäß hat im Gegensatz zum Standard-Impinger einen zusätzlichen Port im oberen Bereich der Waschflasche und einen weiteren im unteren Bereich in der Mitte des Flaschenbodens. Der obere Port (f) dient zum Befüllen des Sammelkopfs mit Sammelflüssigkeit. Der untere Port (g) ermöglicht das Entleeren in den Probenbehälter und ist zusätzlich mit einem Rückschlagventil (h) (4 mm, Fa. Ningde Jingteng Rubber Industry, Fujian, China) ausgestattet. Zur Kontrolle des Volumens an Sammelflüssigkeit im Sammelkopf sind seitlich am Gefäß zwei unabhängige, um 90° versetzte Füllstandssensoren (i) (LLE102000, Fa. Honeywell Deutschland, Offenbach) installiert.
Der Probenbehälter wurde in eine umgebaute Kompressorkühlbox (CoolFreeze CDF11, Fa. Dometic WAECO International, Emsdetten) installiert. Er besteht im Wesentlichen aus einem zylinderförmigen Aluminiumblock (j) mit zwölf runden Bohrungen, in die 50-ml-Rotilabo®-Zentrifugenröhrchen (k) (29 x 115, Fa. Carl Roth, Karlsruhe) passen. Auf diesen wird der Verteilerblock (l) luftdicht aufgesetzt. Er enthält den Eigenbau eines rotierenden 12-Wege-Ventils (m) aus Edelstahl mit Schrittmotor (n) (ST 4209, Fa. Nanotec Electronic, Feldkirchen), das die vom Sammelkopf kommende Probenahmeflüssigkeit nacheinander in die zwölf Zentrifugenröhrchen füllt. Dazu wird im Inneren des Probenbehälters über eine Vakuumpumpe (o) (5002VD-DC, Fa. Gardner Denver, Senden) ein Unterdruck erzeugt, der ausreicht, das Rückschlagventil am Sammelkopf zu öffnen und die Sammelflüssigkeit abzusaugen.
Die Steuereinheit umfasst die gesamte Elektronik, die Vakuumpumpe zum Entleeren des Sammelkopfs sowie eine weitere Pumpe (p) (SR10/30, Fa. Gardner Denver, Senden), um den Sammelkopf mit Sammelflüssigkeit zu befüllen. Das ganze System wird über einen Mikroprozessor (ATmega128, Fa. Atmel, San Jose, CA, USA) gesteuert. Über ein integriertes Tastenfeld mit Display (LCD-Modul 204B, Fa. Displaytech, Carlsbad, Kalifornien, USA) erfolgt die Eingabe der Probenahmeparameter. Minutengenau wählbar sind der Startzeitpunkt, die Probenahmedauer und die Pausenzeit zwischen den Probenahmen. Das Befüllen des Sammelkopfs und das Absaugen der Sammelflüssigkeit pro Zyklus dauern ca. 2 min. Mit dem gegenwärtigen System können nacheinander zwölf Einzelproben genommen werden.
Extern befindet sich die über ein Solid State Relais (Fa. Song Chuan Europe, Altendiez) angesteuerte Vakuumpumpe (D) (N035.1.2 AN.18, Fa. KNF Neuberger, Freiburg). Durch die kritische Düse im Sammelkopf ist der Durchfluss der Probenluft auf 12 l/min beschränkt. Ebenfalls extern befindet sich der Vorratsbehälter für die Sammelflüssigkeit (E). Hierfür wird eine bruchsichere 1 000-ml-Glasflasche (Duran®-Protect, Fa. Carl Roth, Karlsruhe) mit Schraubkappe GL 45 mit zwei Gewindehälsen GL 14 als Deckel verwendet. An dem einen Gewindehals ist ein Druckausgleichsset mit Membranfilter (Porengröße 0,2 µm) (q) (Fa. Carl Roth, Karlsruhe) angeschlossen, der andere führt über einen Schlauch zur Pumpe in der Steuereinheit und von dort zum oberen Port am Sammelkopf. Alle Schläuche sind aus autoklavierbarem Silikon.
2.2 Probenahme
Vor jeder Probenahme wurde das System desinfiziert. Dazu wurde es zweimal mit 70 Vol.-% Ethanol und danach zweimal mit sterilem bidestillierten Wasser gespült. Die beiden Flüssigkeiten wurden in den externen Sammelflüssigkeitsbehälter gegeben und dann wurde über die Pumpe der Sammelkopf befüllt. Bei Erreichen des maximalen Füllstands wurde die Flüssigkeit mithilfe der eingebauten Vakuumpumpe durch das hierfür kontinuierlich rotierende 12-Wege-Ventil in die zwölf Zentrifugenröhrchen verteilt. Nach diesem insgesamt ca. 30 min dauernden Procedere wurden diese Zentrifugenröhrchen für die eigentliche Probenahme durch neue sterile ersetzt. Die Wirksamkeit der Desinfektion wurde in Vorversuchen mit verschiedenen Mikroorganismen, die in das System eingebracht wurden, getestet und bestätigt. Bisher wurden keine Kontaminationen festgestellt.
Um das System im Feld zu testen, wurden zwei Probenahmen durchgeführt: eine in unbelasteter Außenluft mit zu erwartenden geringen Konzentrationen und eine in einer Volierenhaltung für Legehennen mit 800 Tieren mit zu erwartenden hohen Konzentrationen. Die Probenahme außen erfolgte im Sommer 2014 an einem sonnigen Tag auf dem Parkplatz des Thünen-Instituts für Agrartechnologie (52° 17’ 28, 30‘‘ N, 10° 26‘ 10,90‘‘ O) in 1,5 m Höhe über dem Boden über einen Zeitraum von 24 h. Es wurden viermal nacheinander zwölf Proben genommen (n = 48). Die Sammeldauer betrug jeweils 27 min mit 3 min Pause zum Entleeren und neu Befüllen des Sammelkopfs. Start war um Mitternacht; jeweils um 6:00 Uhr, 12:00 Uhr und 18:00 Uhr wurden zwölf Proben entnommen und der Bioaerosolsammler neu bestückt. Die Probenahme im Legehennenstall fand im Herbst 2014 in 1,5 m Höhe über dem Boden an zentraler Stelle in einer Volierenhaltung mit 800 Tieren über einen Zeitraum von 48 h statt. Zweimal nacheinander wurden zwölf Proben genommen (n = 24). Die Sammeldauer betrug jeweils 30 min mit 90 min Pause zwischen den Probenahmen. Start war um 9:00 Uhr morgens, am darauffolgenden Tag um 9:00 Uhr wurden zwölf Proben entnommen und der Bioaerosolsammler neu bestückt (Bild 2).

Bild 2. Probenahme mit dem automatischen Bioaerosolsammler in einer Volierenhaltung.
Foto: Thünen-Institut für Agrartechnologie
Als Sammelflüssigkeit wurde 0,9%ige NaCl-Lösung eingesetzt. Die Füllmenge im Sammelkopf betrug jeweils 30 ml. Alle Proben wurden innerhalb des Systems bei 4 °C (± 1 °C) gelagert. Die Aufarbeitung der Proben erfolgte nach maximal 24 h im Labor. Die Proben aus dem Legehennenstall wurden nach Anlegen einer Verdünnungsreihe im Zweifachansatz auf Caso-Agar (Fa. Carl Roth, Karlsruhe) zur Ermittlung der Anzahl kultivierbarer mesophiler Gesamtbakterien ausplattiert. Bei den Außenluftproben wurde die gesamte Probenmenge durch 47 mm durchmessende Cellulosenitrat-Membranfilter mit 0,45 μm Porengröße (Fa. Carl Roth, Karlsruhe) filtriert und diese auf den Nährboden gelegt. Nach 48 h Bebrütung bei 36 °C wurden die gewachsenen Kolonien gezählt und die Anzahl Kolonie bildender Einheiten (KBE)/m³ berechnet.
3 Ergebnis
Der automatische Bioaerosolsammler funktionierte während aller Versuche einwandfrei. Bild 3 zeigt den 24-h-Verlauf (n = 48) der Konzentrationen mesophiler (36 °C) Gesamtbakterien an einem Sommertag auf dem Parkplatz des Thünen-Instituts für Agrartechnologie. Abgesehen von einigen Peaks (bis 170 KBE/m³) steigen die Konzentrationen von Mitternacht stetig von ca. 20 KBE/m³ bis ca. 80 KBE/m³ bei Sonnenaufgang an und fallen dann langsam wieder zurück auf 20 KBE/m³.
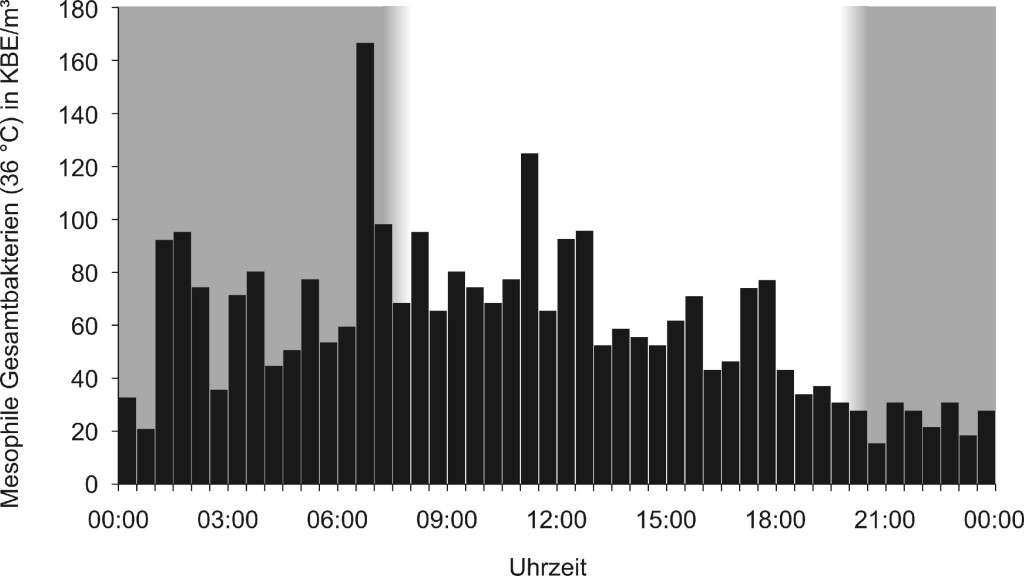
Bild 3. 24-h-Verlauf der Konzentration luftgetragener mesophiler (36 °C) Gesamtbakterien auf dem Parkplatz des Thünen-Instituts für Agrartechnologie an einem sonnigen Tag im Sommer 2013 (n = 48). Die Dunkelphasen sind grau hinterlegt.
Foto: Thünen-Institut für Agrartechnologie
Bild 4 zeigt den 48-h-Verlauf (n = 24) der Konzentration mesophiler Gesamtbakterien (36 °C) in einer Volierenhaltung mit 800 Legehennen. Ein deutlicher Unterschied zwischen Hell- und Dunkelphasen ist zu erkennen. Die mittleren Konzentrationen lagen „nachts“ bei 6,7 ⋅ 105 (n = 10) und „tagsüber“ bei 3,9 ⋅ 106 KBE/m³ (n = 14).
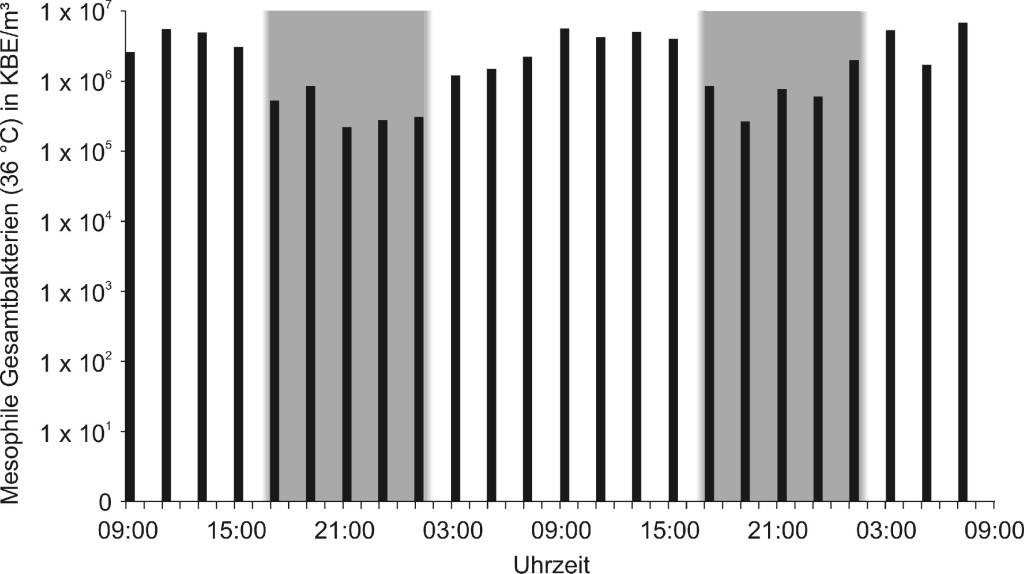
Bild 4. 48-h-Verlauf der Konzentration luftgetragener mesophiler Gesamtbakterien (36 °C) in einer Volierenhaltung mit 800 Legehennen (n = 24). Die Dunkelphasen sind grau hinterlegt.
Foto: Thünen-Institut für Agrartechnologie
4 Diskussion
Die ermittelten durchschnittlichen „Tages“-Konzentrationen liegen in derselben Größenordnung wie die Werte anderer Autoren für unbelastete Außenluft [1; 3] und Volieren für Legehennen [18]. Systembedingt werden durch Flüssigkeitsreste im Sammelkopf und den Verbindungsschläuchen maximal ca. 10 % der vorangegangenen Probe mit in die nächste verschleppt, wie Vorversuche mit Hefezellen zeigten. Bei der Aufnahme von kontinuierlichen Zeitreihen ist dieser Fehler jedoch zu vernachlässigen.
Bemerkenswert sind die teilweise großen Konzentrationsunterschiede zwischen Tag und Nacht, die bei den Legehennen immerhin fast eine Zehnerpotenz betrugen. Um generelle Aussagen treffen zu können, sind jedoch weitere Messungen nötig. Bei den Messungen außen auf dem Parkplatz gab es zudem deutliche Peaks, die Zeiten mit höherer Aktivität zugeordnet werden können, wie dem Arbeitsbeginn gegen 7:00 Uhr (bis 170 KBE/m³), der Mittagspause gegen 12:00 Uhr (bis 125 KBE/m³) und dem Feierabend gegen 17:00 Uhr (bis 75 KBE/m³). Die Konzentrationsspitzen in der Dunkelphase sind vermutlich auf Annäherungen nachtaktiver Tiere auf dem waldähnlichen Gelände des Thünen-Instituts zurückzuführen.
5 Ausblick
Damit das System über noch längere Zeiträume autark sammeln kann, soll die Zahl der möglichen Einzelproben auf 48 erhöht werden. Eine zusätzliche Spülung des Sammelkopfs, jeweils zwischen den einzelnen Probenahmen, soll den Fehler durch Verschleppung von Mikroorganismen der vorangegangenen Probe von derzeit 10 % auf unter 1 % reduzieren. Der nächste Sammelkopf wird angelehnt an den standardisierten Emissionsimpinger nach VDI 4257 Blatt 2 gefertigt, um Langzeitmessungen zur Ermittlung von Emissionsfaktoren von verschiedenen Bioaerosol emittierenden Anlagen durchzuführen.
Literatur
- [1] Clauß, M.; Springorum, A. C.; Hartung, J.: Jahresverlauf der Hintergrundkonzentrationen verschiedener Gruppen luftgetragener Mikroorganismen in einem urbanen, einem Agrar- und einem Forstgebiet in Norddeutschland. Gefahrstoffe – Reinhalt. Luft 73 (2013) Nr. 9, S. 375-380.
- [2] Fang, Z.; Ouyang, Z.; Zheng, H.; Wang, X.: Concentration and size distribution of culturable airborne microorganisms in outdoor environments in Beijing, China. Aerosol Sci. Technol. 42 (2008) Nr. 5, S. 325-334.
- [3] Kolk, A.; van Gelder, R.; Schneider, G.; Gabriel. S.: Mikrobiologische Hintergrundwerte in der Außenluft – Auswertung der BGIA-Expositionsdatenbank MEGA. Gefahrstoffe – Reinhalt. Luft 69 (2009) Nr. 4, S. 130-136.
- [4] Chi, M-C.; Li, C.-S.: Fluorochrome in monitoring atmospheric bio-aerosols and correlations with meteorological factors and air pollutants. Aerosol Sci. Technol. 41 (2007), S. 672-678.
- [5] Hess, G. E.: Effects of oxygen on aerosolized Serratia marcescens. Appl. Microbiol. 13 (1965) Nr. 5, S. 781-787.
- [6] Kundsin, R. B.: Aerosols of mycoplasmas, L Forms and bacteria: Comparison of particle size, viability, and lethality of ultraviolet radiation. Appl. Microbiol. 16 (1968) Nr. 1, S. 143-146.
- [7] Müller, W.; Gröning, K.: Die Tenazität von Bakterien im luftgetragenen Zustand. II. Mitteilung, Experimentelle Untersuchung zur Bestimmung der Absterbekonstante beta für Kokken. Zbl. Bakt. Hyg., I. Abt. Orig.B 173 (1981), S. 180-187.
- [8] Müller, W.; Gröning, K.; Hartmann, F.: Die Tenazität von Bakterien im luftgetragenen Zustand I. Mitteilung: Experimentelle Untersuchung zur Bestimmung der Absterbekonstante beta für E. coli, Salmonella spp. und P. multocida. Zbl. Hyg., I. Abt., Orig. B 172 (1981), S. 367-376.
- [9] Whates, C. M.; Howard, K.; Webster, A. J. F.: The survival of Escherichia coli in an aerosol at air temperatures of 15 and 30 °C and a range of humidities. J. Hyg. (Cambridge) 97 (1986), S. 489-496.
- [10] Wright, D. N.; Bailey, G. D., Hatch, M. T.: Survival of airborne Mycoplasma as affected by relative humidity. J. Bacteriol. 95 (1968) Nr. 1, S. 251-252.
- [11] Wright, D. N.; Bailey, G. D.; Goldberg, L. J.: Effect of temperature on survival of airborne Mycoplasma pneumoniae. J. Bacteriol. 99 (1969) Nr. 2, S. 491-495.
- [12] VDI 4250 Blatt 3 (Entwurf): Bioaerosole und biologische Agenzien – Anlagenbezogene und schutzgutbezogene, umweltmedizinisch relevante Messparameter. Berlin: Beuth 2014.
- [13] Shaffer, B. T.; Lighthart, B.: Survey of culturable airborne bacteria at four diverse locations in Oregon: urban, rural, forest, and coastal. Microb. Ecol. 34 (1997) Nr. 3, S. 167-177.
- [14] Hartung, J.: A new automatic bacteria sampler for air quality research. Proceedings of the 8th International Congress on Animal Hygiene, St. Paul, Minnesota, USA (1994), S. 1-4.
- [15] Pahl, O.; Phillips, V. R.; Lacey, J.; Hartung, J.; Wathes, C. M.: Comparison of commonly used samplers with a novel bioaerosol sampler with automatic plate exchange. J. Aerosol Sci. 28 (1997) Nr. 3, S. 427-435.
- [16] Clauß, M.; Springorum, A. C.; Hartung, J.: Microscopic analysis of size, structure and amount of particulate bioaerosols directly sampled from raw and clean gas of an exhaust air bio-washer in a pig fattening unit. Proceedings of the XVth International Congress of the International Society for Animal Hygiene, Vienna, Austria (2011) Nr. 2, S. 789-791.
- [17] VDI 4252 Blatt 3: Erfassen luftgetragener Mikroorganismen und Viren in der Außenluft – Aktive Probenahme von Bioaerosolen – Abscheidung von luftgetragenen Bakterien mit Impingern nach dem Prinzip der kritischen Düse. Berlin: Beuth 2008.
- [18] Clauß, A. C.: Mikrobiologische Belastungen in alternativen Legehennenhaltungen aus Sicht des Arbeits- und Umweltschutzes. Dissertation Universität Witten/Herdecke 2014.
Dr. Marcus Clauß - Thünen-Institut für Agrartechnologie, Braunschweig.