Ornithogene Auswirkungen auf die Flechten eines Erlenwalds am Beispiel einer Nistkolonie des Kormorans
Zusammenfassung Die Flechtendiversität in einem Erlenwald im Einflussbereich einer Kormorankolonie an der Südküste des Kurischen Haffs zeigte einen eindeutigen Rückgang von 30 Arten in einem Referenz-Waldgebiet, das nicht von Nestbauaktivitäten des Kormorans betroffen ist, auf neun nitrophytische Flechtenarten in der unmittelbaren Umgebung der Kolonie. Hier wurden in den Flechtenthalli erhöhte Gehalte an Fotosynthesepigmenten und Stickstoff im Vergleich zu den untersuchten Vergleichsflächen gefunden. Die Eutrophierung wird als Ursache für die Veränderungen physiologischer und biochemischer Parameter und für Störungen der Flechtensymbiose angenommen, die zu einem Absterben von Flechten und dem Rückgang der Biodiversität führen können.

Bild 1. Nest des Kormorans auf einer Erle.
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
1 Einleitung
Bis heute wird die Eutrophierung von Ökosystemen als globales Umweltproblem angesehen. Hauptursache ist der Nährstoffeintrag aus der Luft, verursacht durch Ammoniak- und Stickstoffoxid-Emissionen durch menschliche Aktivitäten (Landwirtschaft, Industrie und Verkehr) [1]. Neben der anthropogenen großräumigen Eutrophierung gibt es jedoch auch natürliche Ursachen für einen übermäßigen Nährstoffeintrag und seine ökosystemaren Folgen. Eine davon soll hier behandelt werden.
Im 21. Jahrhundert beobachtet man im Zuge eines faunistischen Wandels in großen Regionen Europas auch die Expansion einiger Vogelarten aufgrund der Erweiterung ihrer Lebensräume [2 bis 4]. Dazu gehört der in Kolonien brütende Kormoran Phalacrocorax carbo (Bild 1), dessen Vorkommen deutliche Veränderungen der Habitate mit sich bringt.
Eine Größenordnung bezüglich des Stoffumsatzes geben Klimaszyk und Rzymski, wonach Kormorane täglich 0,4 kg Nahrung konsumieren und 20 bis 50 g Fäkalien absetzen [5]. Die ökosystemaren Auswirkungen von Kormoran-Nistkolonien sind belegt. In der genannten Arbeit wurde gezeigt, dass Kormorane einen signifikanten Einfluss auf die Vegetation haben, der sich zum einen in einer mechanischen Zerstörung der Bäume und zum anderen in der Akkumulation von Fäkalien und anderen ornithogenen Abfällen in der Nistkolonie niederschlägt. Zu den Konsequenzen gehören chemische und physikalische Veränderungen der Böden und des Grundwassers.
Es wird vermutet, dass die Freisetzung von Fäkalien im Einflussbereich der Nistkolonien auch Flechten beeinflusst. Ein direkter Effekt könnte das Beaufschlagen von Abfall direkt auf den Flechtenthallus oder die Baumstämme (Schwarz-Erle) sein. Als indirekter Effekt kann die Veränderung des Borken-pH-Werts angesehen werden [6].
Es ist bekannt, dass Flechten besonders empfindlich auf Veränderungen der Luftqualität reagieren. Ohne Wurzeln nehmen sie Wasser, gelöste Mineralien und Gase über die gesamte Oberfläche des Thallus auf [7]. Die Auswirkungen einer übermäßigen Zufuhr von Stickstoff auf die Flechten sind auf dem zellulären, organismischen und populationsspezifischen Organisationsniveau relativ gut bekannt [7]. Das Zusammenwirken von Stickstoffüberdüngung mit anderen Stressoren sollte jedoch weiter untersucht werden. So war es Ziel dieser Studie, die Auswirkungen einer Kormorankolonie auf die Flechten des Erlenwalds zu bewerten.
2 Untersuchungsgebiet
Das Untersuchungsgebiet liegt an der Ostsee im Kaliningrader Gebiet in Russland. Die hier betrachtete Kormorankolonie ist eine von drei großen Kolonien des Kaliningrader Gebiets (Bild 2).
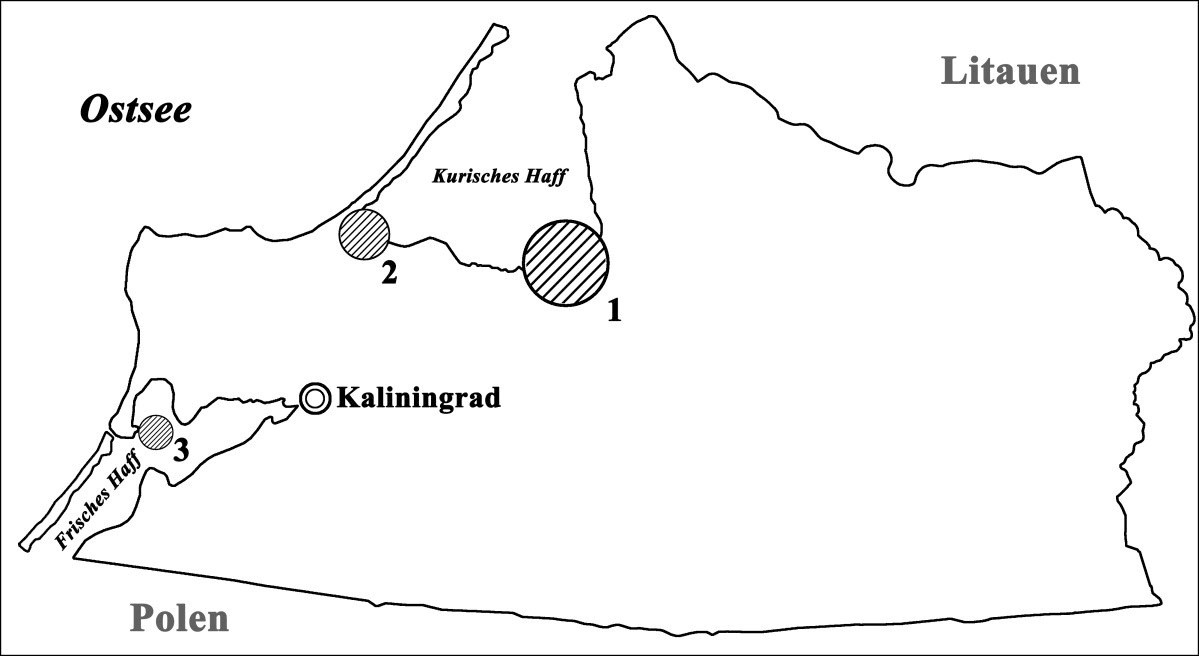
Bild 2. Lage der Kormorankolonien auf dem Territorium des Kaliningrader Gebiets: 1 – untersuchte Kolonie (75 ha, 9 000 Brutpaare); 2 – Kolonie an der Südwestküste des Kurischen Haffs (6,5 ha, 700 Brutpaare); 3 – Kolonie in der Nähe der Stadt Baltijsk (3,7 ha, 300 Brutpaare).
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
Sie befindet sich in der Deimamündung an der Südküste des Kurischen Haffs und beansprucht eine Fläche von mehr als 75 Hektar. Derzeit ist diese Nistkolonie eine der größten im südöstlichen Ostseebereich und hat etwa 9 000 Brutpaare. Die anderen großen Kormorankolonien an der Ostseeküste befinden sich am Frischen Haff neben der Siedlung Ka˛ty Rybackie, Polen (6 450 Brutpaare), am Stettiner Haff (insgesamt 13 800 Paare verteilt auf sechs Kolonien in Deutschland und Polen) und auf der Kurischen Nehrung neben Juodkrante, Litauen (ca. 3 000 Paare) [8; 9].
Die untersuchte Kormorankolonie befindet sich in einem sumpfigen Erlenwald. Von Südwesten nach Nordosten durchzieht ein Damm den Wald. Im Norden des Damms wird der Wald von den Gewässern des Haffs überflutet. Die am häufigsten vorkommenden Baumspezies auf dem Gebiet der Kolonie sind Schwarz-Erle (Alnus glutinosa L.), Gemeine Fichte (Picea abies L.), Stieleiche (Quercus robur L.), und Hänge-Birke (Betula pendula Roth).
In der Strauchschicht sind Gewöhnliche Traubenkirsche (Padus racemosa L.), Himbeere (Rubus idaeus L.) und Rote Johannisbeere (Ribes rubrum L.) häufig anzutreffen. In der Krautschicht dominieren Große Brennnessel (Urtica dioica L.), Schwarzer Nachtschatten (Solanum nigrum L.), Sumpf-Schwertlilie (Iris pseudacorus L.) und Wasserschierling (Cicuta virosa L.) [10].
Das Untersuchungsgebiet wurde in fünf Untersuchungsflächen aufgeteilt, die alle im Erlenwald und in unterschiedlicher Position zur Kormorankolonie liegen (Bild 3).
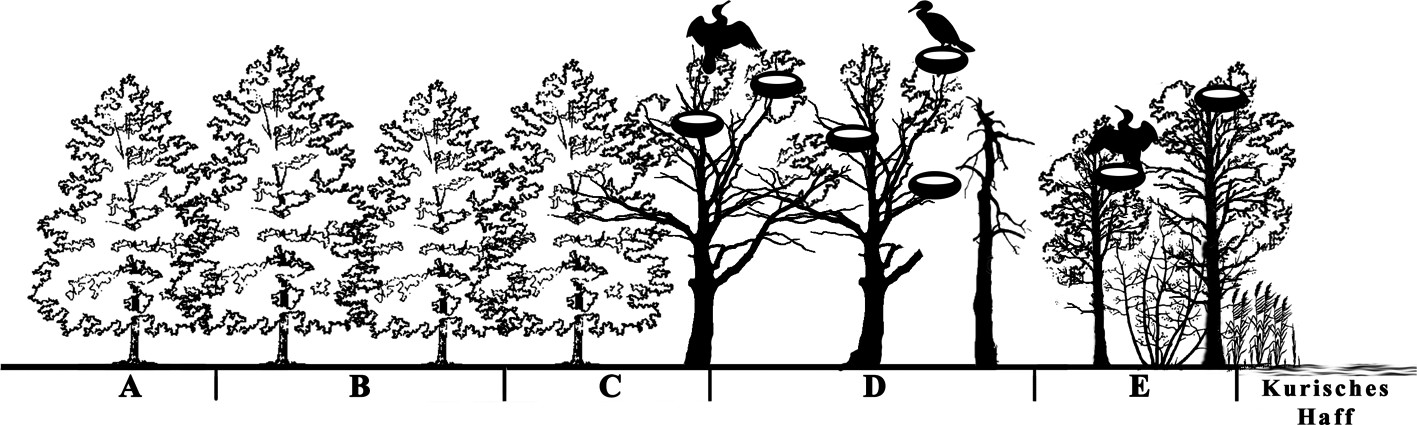
Bild 3. Untersuchte Gebiete: A und B – Referenzgebiete; C – an der Grenze zur Kolonie; D – Hauptsiedlungsort der Kormorankolonie; E – Küstenabschnitt mit Bäumen, die vor Kurzem von Kormoranen bewohnt waren.
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
Das Gebiet A liegt als Referenz etwa 450 Meter südlich der Kormorankolonie. Das Gebiet B ist noch 300 Meter von der Kolonie entfernt und ebenfalls nicht von Nestbauaktivitäten des Kormorans betroffen. Das Gebiet C liegt an der Grenze zur Kolonie und 120 Meter vom Koloniezentrum entfernt. Das Gebiet D ist der Hauptsiedlungsort der Kormorankolonie. Das Gebiet E liegt küstennah und weist Bäume auf, die noch vor Kurzem von den Vögeln bewohnt wurden.
3 Material und Methoden
3.1 Artenerfassung und Probenahme
In der Feldsaison 2016/2017 wurden zunächst die Baumarten und die Anwesenheit von Vogelnestern festgestellt. Es erfolgte eine Kartierung der epiphytischen Flechtenarten sowie die Probenahme von Flechten von allen verfügbaren Rindensubstraten, wie von Stämmen lebender oder umgefallener Bäume oder auch von abgefallenen Ästen. Dabei wurde insgesamt eine Fläche von 9 000 m2 erforscht.
Um den Einfluss der Kormorankolonie auf den Gehalt an fotosynthetischen Pigmenten und die Elementzusammensetzung von Flechten zu untersuchen, wurde die epiphytische Flechte Parmelia sulcata Taylor als Modellobjekt ausgewählt. Insgesamt wurden 21 Flechtenproben gesammelt (fünf Proben im Gebiet A, sechs Proben im Gebiet B und zehn Proben im Gebiet C). In den anderen Untersuchungsflächen (D bis E) gab es keine Parmelia sulcata.
3.2 Stickstoff-, Phosphor- und Chlorophyllbestimmung in Parmelia sulcata
Die Bestimmung der Flechten und die Laboranalyse des Chlorophyll- und Phosphorgehalts in den Flechtenproben wurden im Herbarium (KLGU) und im Laboratorium für Natürliche Antioxidantien der School of Life Science der Baltischen Föderalen Immanuel-Kant-Universität durchgeführt. Die Analyse des Stickstoffgehalts der Flechten erfolgte in der Technischen Hochschule Mittelhessen.
Die Bestimmung des Chlorophyllgehalts von Parmelia sulcata wurde spektrofotometrisch (Spektralfotometer Shimadzu UV-3600) nach Barnes et al. vorgenommen [11]. Für die Extraktion der Pigmente wurde Dimethylsulfoxid (DMSO, 99 % Reinheit) verwendet. Die Ergebnisse wurden in mg/g Trockengewicht (TG) des Thallus angegeben.
Der Phosphorgehalt in Parmelia sulcata wurde mittels einer spektrofotometrischen Methode bestimmt. Vor der Analyse wurden die Flechtenproben bis zur Gewichtskonstanz getrocknet. Danach wurden die Proben durch das Nassveraschungsverfahren mineralisiert. Die Methode orientierte sich an der Arbeit [12]. Bei der Mineralisierung bilden sich Ammoniumsalze und ortho-Phosphorsäure in der Lösung. Die nachfolgende Analyse basiert auf der Umsetzung von Phosphorverbindungen mit Ammoniummolybdat in saurem Medium, wobei mit Phosphormolybdänblau eine blau gefärbte Verbindung entsteht.
Der Gesamtstickstoffgehalt in Parmelia sulcata [13] wurde am CHNS-Elementaranalysator (Elementar vario EL cube) gemessen. Als Standard diente Sulfanilsäure.
Die statistische und grafische Datenanalyse wurde mittels des Programms IBM SPSS Statistics durchgeführt. Unterschiede zwischen den Werten wurden mit nichtparametrischen Tests (Kruskal-Wallis-Test, Mann-Whitney-U-Test) bestimmt. Zusammenhänge zwischen den untersuchten Parametern sowie ihrer Stärke und Richtung ließen sich mit Hilfe der zweiseitigen Korrelationsanalyse nach Spearman (Rangkorrelationskoeffizient rS) ermitteln.
4 Ergebnisse
Die Erfassung der epiphytischen Flechten ergab insgesamt 31 Arten (Tabelle 1).
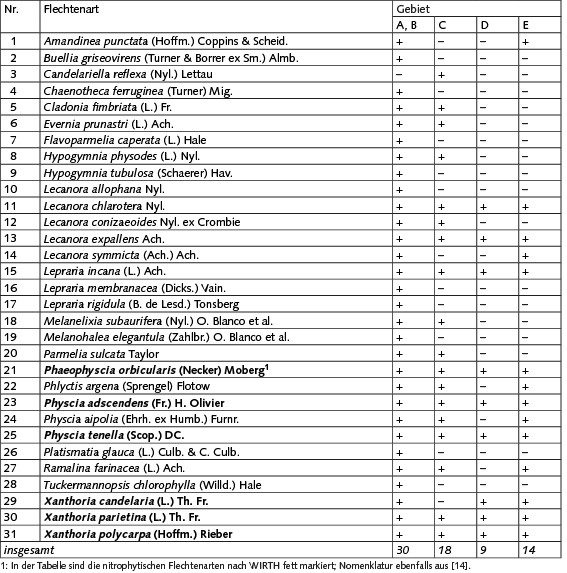
Tabelle 1. Verbreitung von Flechten in Erlenwaldgebieten an der Südostküste des Kurischen Haffs (Mündung des Flusses Deima), +: nachgewiesen -: nicht nachgewiesen
Die Artenliste der Flechtenbiota in den Gebiet A und B ist identisch und beläuft sich auf 30 Arten. Im Untersuchungsgebiet sind Evernia prunastri, Hypogymnia physodes, Parmelia sulcata, Phlyctis argena, Melanelixia subaurifera, Melanohalea elegantula, Ramalina farinacea und Lepraria incana auf den Stämmen der Schwarz-Erle weit verbreitet. Auf den Zweigen der Erle herrschen die Krustenflechten der Gattung Lecanora und Blattflechten der Gattung Physcia und Xanthoria vor.
Im Grenzgebiet C wurden 18 Flechtenarten nachgewiesen. Hier sind die Bestände der Strauchflechten Evernia prunastri und Ramalina farinacea deutlich verringert. Die Thalli der Blattflechten Hypogymnia physodes und Parmelia sulcata zeigen nekrotische Läsionen (Bild 4.1), Veränderungen in der Thallusmorphologie und einen allgemein schlechten Zustand, was auf ungünstige Wachstumsbedingungen hinweist. Hier sind Phaeophyscia orbicularis, Physcia adscendens, Physcia tenella, Xanthoria parietina und Xanthoria polycarpa auf den Stämmen weit verbreitet.
Am Hauptsiedlungsort der Kolonie (Gebiet D), der während der gesamten Lebensdauer der Nistkolonie von Vögeln bewohnt war (Bild 4.2), wurden neun Flechtenarten nachgewiesen. Hier finden sich überwiegend nitrophytische Spezies (Bild 4.3), die einen erhöhten Stickstoffeintrag tolerieren. Die Krustenflechten Lepraria incana, Lecanora chlarotera und Lecanora expallens sind in diesem Gebiet nur in einzelnen Exemplaren auf mehreren Bäumen gefunden worden.

Bild 4. Die untersuchten Gebiete der Nistkolonie des Kormorans: 1 – Parmelia sulcata mit nekrotischen Läsionen; 2 – Situation am Hauptsiedlungsort der Kolonie; 3 – nitrophytische Flechtenarten Phaeophyscia orbicularis und Xanthoria parietina.
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
Im küstennahen Gebiet E mit jungen Bäumen, deren Besiedlung durch Kormorane erst 2012 begann, wurden 14 Flechtenarten gefunden. Hier dominieren, wie im Zentrum der Kolonie, die nitrophytischen Arten. In einzelnen Exemplaren wurden an den Erlenstämmen Amandinea punctata, Lecanora expallens, Lepraria incana, Phlyctis argena und Ramalina farinacea erfasst; auf den Zweigen fanden sich Lecanora chlarotera, Lecanora symmicta und Physcia aipolia.
Die Ergebnisse der Bestimmung des Gehalts an fotosynthetischen Pigmenten, Stickstoff und Phosphor in den Blattflechten Parmelia sulcata sind in Tabelle 2 dargestellt.
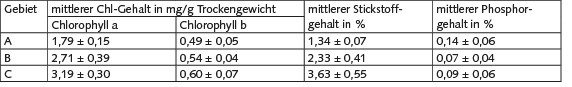
Tabelle 2. Der Gehalt an fotosynthetischen Pigmenten, Stickstoff und Phosphor in Parmelia sulcata in untersuchten Erlenwald-Gebieten
Die Spanne des Chlorophyll-a-Gehalts beträgt für die Einzelproben 1,53 bis 3,68 mg/g, die des Chlorophyll-b-Gehalts 0,44 bis 0,73 mg/g. Dabei nahm der Gehalt der Fotosynthesepigmente in Parmelia sulcata zur Kormorankolonie hin zu. Es wurde ein signifikanter Anstieg (p < 0,05) des Chlorophyll-a-Gehalts sowohl von Gebiet A nach B als auch von Gebiet B nach C gefunden. Der Chlorophyll-b-Gehalt unterscheidet sich nur zwischen den Flechtenproben der Gebiete B und C. Die Mediane steigen sowohl für Chlorophyll a als auch für Chlorophyll b zur Kolonie hin an (Bild 5).
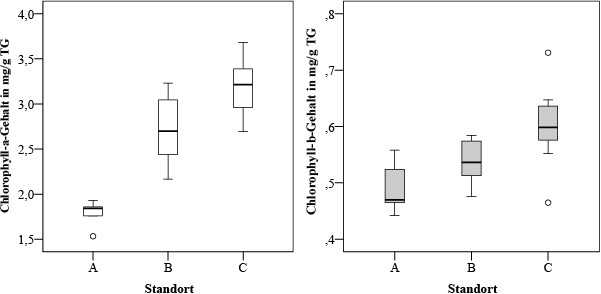
Bild 5. Gehalt an Fotosynthesepigmenten in den Flechtenproben Parmelia sulcata in untersuchten Erlenwaldgebieten.
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
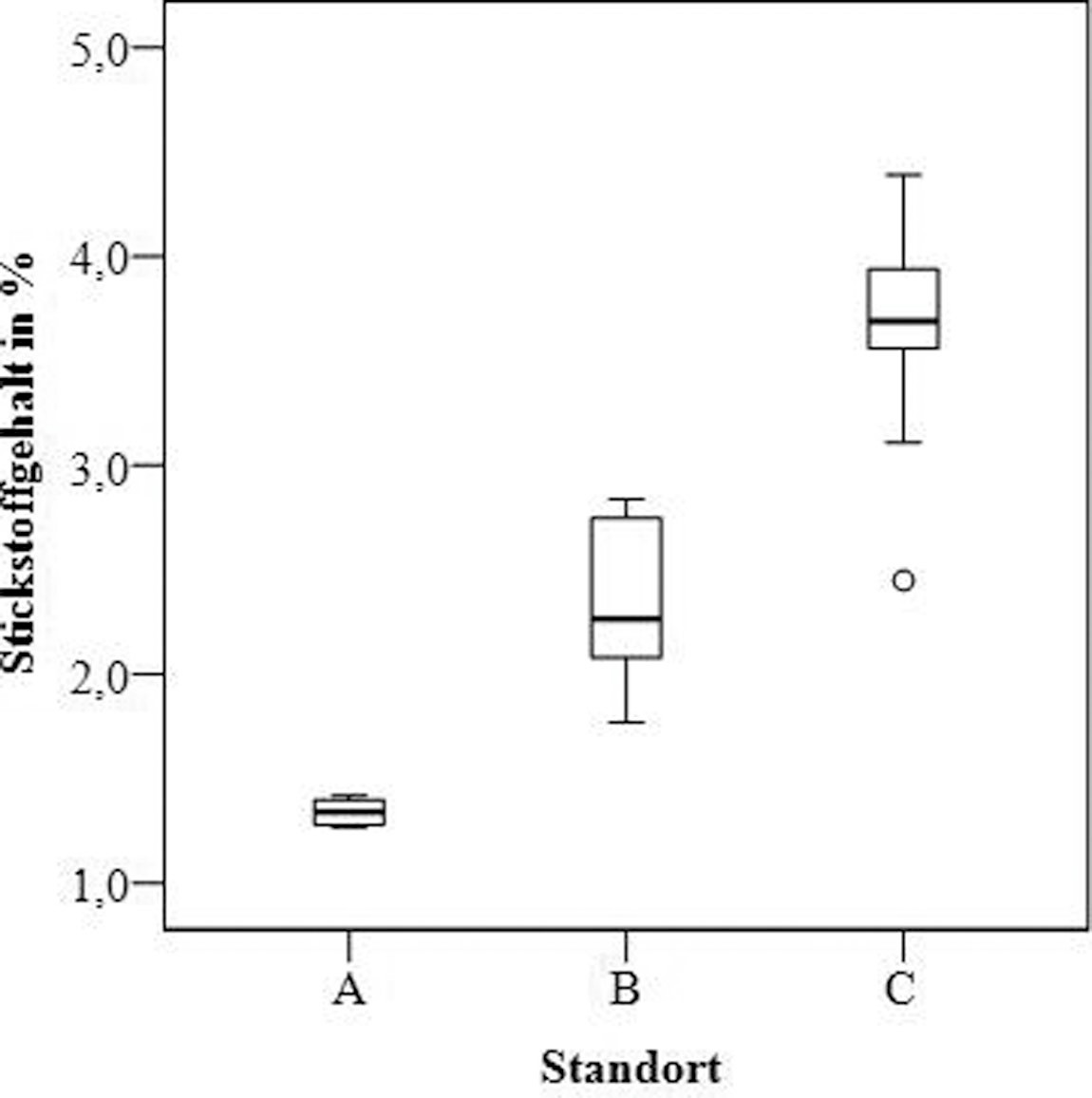
Der Stickstoffgehalt in Parmelia sulcata variiert von 1,27 bis 4,39 % des Trockengewichts (Bild 6).
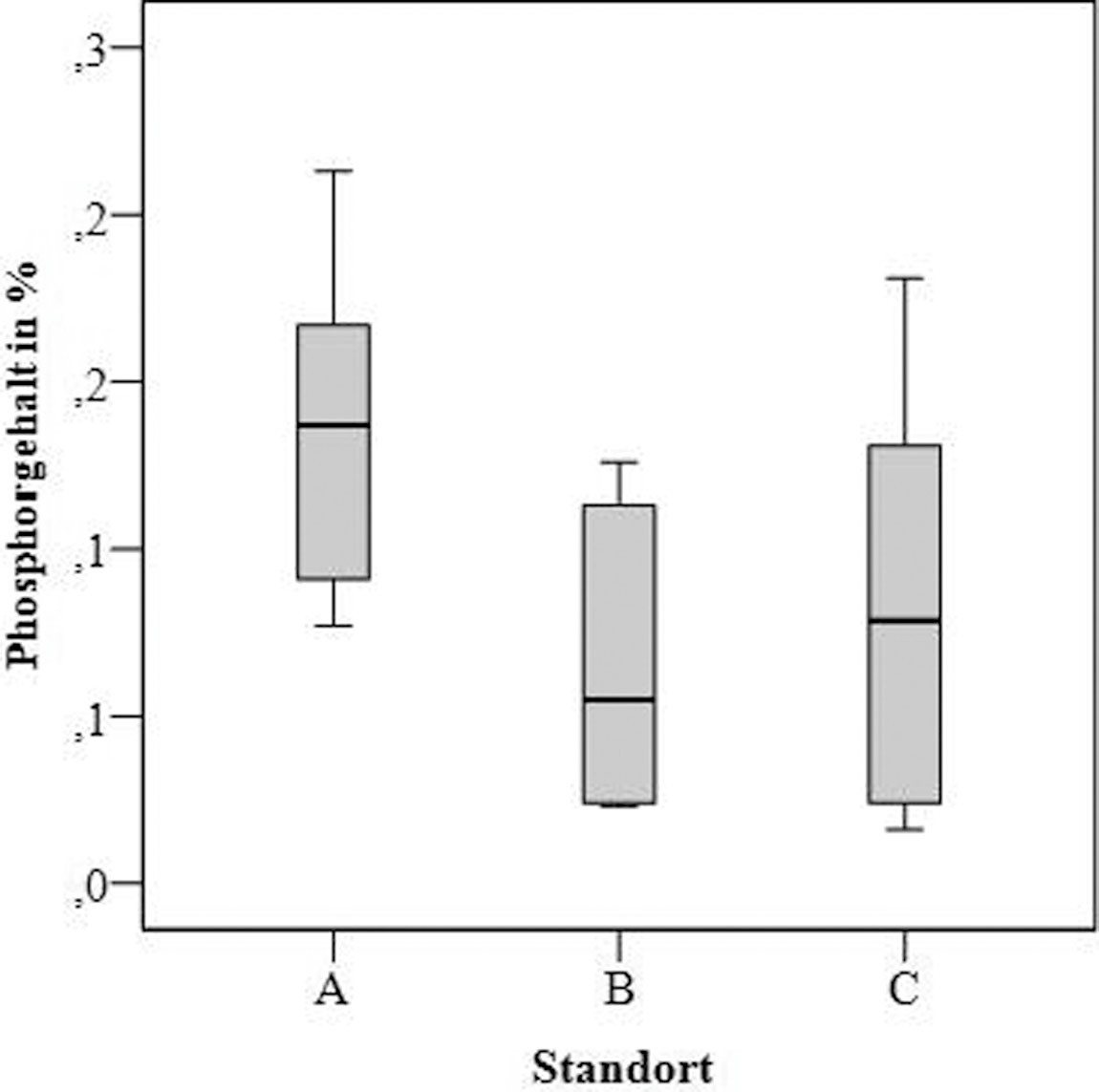
Bild 6. Stickstoff- und Phosphorgehalt von Parmelia sulcata in untersuchten Erlenwaldgebieten
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
Die Analyse zeigte eine signifikante Erhöhung (p < 0,01) der Stickstoffgehalte sowohl von Gebiet A nach B als auch von Gebiet B nach C. Der Phosphorgehalt in allen Proben von Parmelia sulcata variiert von 0,02 bis 0,21 % und zeigte keine signifikanten Unterschiede für die untersuchten Gebiete (Bild 6).
Zwischen dem Stickstoff- und dem Chlorophyll-a-Gehalt wurde eine deutliche positive Korrelation gefunden (rs = 0,87; p < 0,001); die des Stickstoff- und Chlorophyll-b-Gehalts ist etwas geringer (rs = 0,72; p < 0,001) (Bild 7).
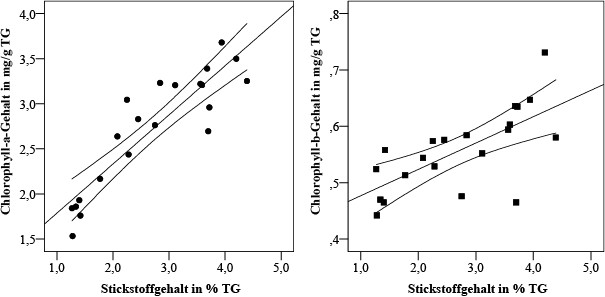
Bild 7. Streuung der Abhängigkeit des Gehalts an fotosynthetischen Pigmenten vom Stickstoffgehalt in Parmelia sulcata; Konfidenzintervall 95 %
Foto: Immanuel Kant Baltic Federal University/ TH Gießen
Eine mäßige negative Beziehung wurde zwischen dem Chlorophyll-a- und dem Phosphor-Gehalt festgestellt (rs = -0,50; p < 0,01).
5 Diskussion
Alle untersuchten Parameter belegen deutliche Eutrophierungswirkungen, die von der Kormorankolonie verursacht werden. Die Flechtendiversität wird im Einflussbereich der Kormorankolonie beeinträchtigt. Ein Rückgang der Artenzahl von 30 Spezies auf den Referenzflächen auf neun Arten im Hauptsiedlungsgebiet der Kormorankolonie wird verzeichnet, dort dominieren die nitrophytischen Flechten. Ähnliche Resultate wurden in einer Flechtenkartierung 2015 in einem Erlenwald an der Südwestküste des Kurischen Haffs, 38 Kilometer westlich des Untersuchungsgebiets, verzeichnet. Dort sank die Artenzahl von ursprünglich 32 Arten deutlich ab. Strauch- und Blattflechten wurden in Bereichen mit hohen Nestdichten nicht mehr gefunden [15].
Der Einfluss einer Kormorankolonie auf die Flechtenbiota äußert sich in Form chemischer Verschmutzung der Habitate. Direkte Auswirkungen sind mit dem Abwurf von Vogelkot direkt auf die Flechtenthalli oder auf die Erlenstämme verbunden, die nekrotische Läsionen und das Absterben der Flechten zur Folge haben und zur Veränderung des Borken-pH-Werts führen [6]. Nach Van Eerden et al. sind Kormorane nicht länger als vier Stunden am Tag mit der Nahrungssuche beschäftigt, wodurch mehr als 80 % der Fäkalien auf dem Territorium der Kolonie abgelagert werden [4]. Vogelkot ist reich an Nährstoffen wie Stickstoff und Phosphor. Der Kot des Kormorans enthält 3,2 bis 14,5 % Stickstoff und 5,9 bis 14 % Phosphor, mit einem Verhältnis von Stickstoff zu Phosphor von durchschnittlich 1,5:1 [5; 16]. Ein Individuum scheidet täglich mehr als 4 g Stickstoff und 2,5 g Phosphor aus [5]. Bei der Dichte der untersuchten Kormoranpopulation sammeln sich demnach pro Hektar und Jahr 181 bis 1 120 kg Stickstoff und 112 bis 786 kg Phosphor als Sediment an [5; 17].
Die Erhöhung des Stickstoffgehalts in den Thalli von Parmelia sulcata in Gebieten, die noch nicht durch Nestbauaktivität belegt sind (wie in den Gebieten B und C) deutet auf eine atmosphärische Freisetzung des Stickstoffs und Aufnahme durch die Flechten hin. Flechten sind in der Lage, Stickstoff in Form von Ammoniak und Ammonium zu absorbieren, in geringerem Maße als Nitrat [18]. Im Untersuchungsgebiet ist die Stickstoffquelle aller Wahrscheinlichkeit nach der Vogelkot, der bei seiner Zersetzung Ammoniak freisetzt. In der Atmosphäre können daraus Ammoniumsalze gebildet werden, die trocken oder nass auf die Flechten deponiert werden [19].
Die Korrelation zwischen dem Gehalt des Stickstoffs und dem der fotosynthetischen Pigmente im Thallus von Parmelia sulcata steht im Einklang mit der Tatsache, dass Stickstoff ein Bestandteil des Chlorophyllmoleküls ist. Mit zunehmender Stickstoffanreicherung im Thallus wird die Synthese von Fotosynthesepigmenten forciert [20; 21]. Das Wachstum des Fotobiontenanteils im Flechtenthallus erhöht das Verhältnis des Fotobionten zum Mycobionten, was zum Zusammenbruch der fein ausbalancierten Flechtensymbiose führen kann. Der Mycobiont ist verantwortlich für die Struktur und Stabilität des Flechtenthallus [18].
In unserer Arbeit wurden keine signifikanten Unterschiede im Phosphorgehalt der Proben von Parmelia sulcata festgestellt. In Experimenten mit Nährstoffapplikation auf Flechten erhöhte sich durch eine Stickstoffakkumulation das Verhältnis von Stickstoff zu Phosphor [20]. Die physiologischen Folgen der Phosphorlimitierung in Flechten im Vergleich zu Gefäßpflanzen sind unzureichend untersucht [20]. Die allgemeine Hypothese ist jedoch, dass Flechten eine ausreichende Menge Phosphor benötigen, um zusätzliche Stickstoffvolumina dafür zu nutzen, neue Fotobiontenzellen zu bilden [22].
Danksagung
Die Studie wurde finanziert von der Russian Foundation for Basic Research (RFBR) im Rahmen des wissenschaftlichen Projektes No. 16-34-00353 MOa.
Literatur
[1] Geupel, M.; Frommer, J.: Reaktiver Stickstoff in Deutschland. Ursachen, Wirkungen, Maßnahmen. Hrsg.: Umweltbundesamt, Dessau-Roßlau 2015.
[2] Bzoma, S.; Goc, M.; Brylski, T.; Stempniewicz L.; Iliszko, L.: Seasonal changes and intracolony differentiation in the exploitation of two feeding grounds by Great Cormorants (Phalacrocorax carbo sinensis) breeding at Ka˛ty Rybackie (N Poland). Vogelwelt 124 (2003), S. 175-181.
[3] White, C. R.; Boertmann, D.; Gremillet, D.; Butler, P. J.; Green, J. A.; Martin, G. R.: The relationship between sea surface temperature and population growth of Great Cormorants near Disco Bay, Greenland. Ibis 153 (2011), S. 170-174.
[4] van Eerden, M. R.; van Rijn, S.; Volponi, S., Paquet J.-Y.; Carss, D.: Cormorant and the European environment: Exploring cormorant ecology on a continental scale 2012. COST Action 635 Final Report I.
[5] Klimaszyk, P.; Rzymski, P.: The complexity of ecological impacts induced by great cormorants. Hydrobiologia 771 (2016), S. 13-30.
[6] Motiejūnaitė, J.; Iršėnaitė, R.; Adamonyte, G.; Dagys, M.; Taraškevicius, R.; Matuleviciute, D.; Koreiviene, J.: Pine forest lichens under eutrophication generated by a great cormorant colony. Lichenologist (London) 46 (2014) Nr. 2, S. 213-228.
[7] Carter, T. S.; Clark, C. M.; Fenn, M. E.; Jovan, S.; Perakis, S. S.; Riddell, J.; Schaberg, P. G.; Greaver, T. L.; Hastings, M. G.: Mechanisms of nitrogen deposition effects on temperate forest lichens and trees. Ecosphere 8 (2017) Nr. 3, S. 1-26.
[8] Bregnballe, T.; Lynch, J.; Parz-Gollner, R.; Marion, L.; Volponi, S.; Paquet, J.-Y.; Carss, D. N.; van Eerden, M. R.: Breeding numbers of Great Cormorants Phalacrocorax carbo in the Western Palearctic, 2012- 2013. IUCN-Wetlands International Cormorant Research Group Report – Scientific Report from DCE – Danish Centre for Environment and Energy (2014), Nr. 99.
[9] Chaika, C. V.; Grishanov, G. V.; Grishanova, Yu. N.: Impact of the great cormorant (Phalacrocorax carbo L.) breeding colony on the community of nesting birds. Bull. of ISU 17 (2016), S. 82-97.
[10] Grišhanov, G.V.; Cajka K.V.: Der Kormoran Phalacrocorax carbo sinensis (Shaw & Nodder 1801) im Kaliningrader Gebiet – Geschichte und heutiger Status. Ornithol. Mitt. 64 (2012) Nr. 11/12, S. 297-304.
[11] Barnes, J. D.; Balaguer, L.; Manrique, E.; Elvira, S.; Davison, A. W.: A reappraisal of the use of DMSO for the extraction and determination of chlorophylls a and b in lichens and higher plants. Environ. Exp. Bot. 32 (1992), Nr. 2, S. 85-100.
[12] Voskresenskaya, O. L.: Praktikum für Bioökologie. Teil 1. Lehrmittel. Mari State University. Joschkar-Ola (Russland), 2006.
[13] VDI 3957 Blatt 18: Biologische Messverfahren zur Ermittlung und Beurteilung der Wirkung von Luftverunreinigungen (Bioindikation). Erfassen von Stickstoffanreicherungen in der Blattflechte Parmelia sulcata zum Nachweis von Immissionswirkungen (12/2015). Berlin: Beuth 2015.
[14] Wirth, V.: Ökologische Zeigerwerte von Flechten – erweiterte und aktualisierte Fassung. Herzogia 23 (2010) Nr. 2, S. 229-248.
[15] Pungin, A. V.; Chaika, Ch. V.; Grishanov, G. V.; Petrenko, D. E.; Korolyov, K. S.: Lichens of alder forest under the influence of great cormorant colony (Curonian lagoon, Kaliningrad region). Botan. Zh. 100 (2015) Nr. 11, S. 1154-1161.
[16] Gwiazda, R.; Jarocha, K.; Szarek-Gwiazda, E.: Impact of small cormorant (Phalacrocorax carbo sinensis) roost on nutrients and phytoplankton assemblages in the littoral regions of submontane reservoir. Biologia 65 (2010), S. 742-748.
[17] Goc, M.; Iliszko, L.; Stempniewicz, L.: The largest European colony of great cormorant on the Vistula spit (N Poland) – an impact of the forest ecosystem. Ecol. Quest. 6 (2005), S. 93-103.
[18] Johansson, O.; Palmqvist, K.; Olofsson, J.: Nitrogen deposition drives lichen community changes through differential species responses. Glob. Change Biol. 18 (2012) Nr. 8, S. 2626-2635.
[19] Moore, P. A.; Daniel, T. C.; Edwards, D. R.; Miller, D. M.: Effect of chemical amendments on ammonia volatilization from poultry litter. J. Environ. Qual. 24 (1995) Nr. 2, S. 293-300.
[20] Clark, C. M.; Bell, M. D.; Boyd, J. W.; Compton, J. E.; Davidson, E. A.; Davis, C.; Fenn, M. E.; Geiser, L.; Jones, L.; Blett, T. F.: Nitrogen-induced terrestrial eutrophication: cascading effects and impacts on ecosystem services. Ecosphere 8 (2017) Nr. 7, S. 1-17.
[21] Hauck, M.: Ammonium and nitrate tolerance in lichens. Environ. Pollut. 158 (2010) Nr. 5, S. 1127-1133.
[22] Johansson, O.; Olofsson, J.; Giesler, R.; Palmqvist, K.: Lichen responses to nitrogen and phosphorus additions can be explained by the different symbiont responses. New Phytol. 191 (2011), S. 795-805. Artem Pungin, Dr. Christina Chaika,
Dr. Liubov Skrypnik - Immanuel Kant Baltic Federal University, Kaliningrad,Russland.
Prof. Dr. Ute Windisch, Technische Hochschule Mittelhessen, Gießen.