Sammlung luftgetragener Mikroorganismen in Umweltbereichen mit geringen Konzentrationen
Zusammenfassung In vielen Umweltbereichen liegen die Konzentrationen luftgetragener Mikroorganismen an der unteren Nachweisgrenze der standardisierten Probenahmeverfahren. In dieser Untersuchung werden ein Coriolis®-µ-Zyklonsammler, ein MAS-100-NT®-Impaktor und ein AGI-30-Impinger für die Erfassung von luftgetragenen Mikroorganismen in Umweltbereichen mit geringen Konzentrationen eingesetzt und die Ergebnisse unter praktischen Gesichtspunkten diskutiert. Hierbei zeigte der MAS-100 NT® die höchste Sammeleffizienz, jedoch kann mit diesem System nur die Anzahl mikroorganismentragender Partikel erfasst werden. Der Coriolis®-µ hat theoretisch die geringste Nachweisgrenze. Der AGI-30-Impinger hat den Vorteil, dass er als standardisiertes Probenahmesystem schon lange eingesetzt wird und daher entsprechend viele Vergleichsdaten vorliegen.
Quelle: PantherMedia/zozu
1 Einleitung
Die natürliche Hintergrundkonzentration von luftgetragenen Mikroorganismen liegt in unseren Breiten für Gesamtbakterien (36 °C) im Mittel zwischen 100 und 800 KBE/m³ (KBE = Kolonie bildende Einheiten) und für mesophile Gesamtpilze (25 °C) zwischen 100 und 4 000 KBE/m³ [1; 2]. Die Konzentrationen spezifischer Gruppen von Mikroorganismen sind entsprechend niedriger, z. B. die der Staphylokokken im Mittel zwischen 3 und 16 KBE/m³ [2 bis 4]. Auch in urbanen Gegenden oder Waldgebieten mit weiteren anthropogenen oder natürlichen Bioaerosolquellen sind die Konzentrationen i. d. R. eher niedrig.
Zur Messung der Hintergrundkonzentration luftgetragener Bakterien wird in der Richtlinie VDI 4252 Blatt 3 der Impinger AGI-30 vorgegeben [5], mit dem Bioaerosole nach dem Prinzip der kritischen Düse in einer Flüssigkeit abgeschieden werden. Dabei werden sie nahezu auf Schallgeschwindigkeit beschleunigt und prallen dann auf die Flüssigkeitsoberfläche. Die kritische Düse und auch der vorgelagerte Krümmer des Impingers sind der Grund für relativ hohe systeminterne Verluste und die entsprechend geringere physikalische Sammeleffizienz [6; 7]. Berechnungen zeigten, dass beim AGI-30 von 10 µm großen Partikeln nur etwa 20 bis 30 % erfasst werden [7]. Mit dem AGI-30 können z. B. in 30 min Sammelzeit bei einem festen Volumenstrom von 12 l/min Mikroorganismen aus 0,36 m³ Luft in 30 ml Flüssigkeit gesammelt werden.
Es stehen auch alternative Sammelsysteme zur Verfügung, mit denen in kürzerer Zeit ein höheres Luftvolumen beprobt werden kann. Zum Beispiel werden Impaktoren für Messungen in Innenräumen bei bekannt niedrigen Konzentrationen luftgetragener Mikroorganismen eingesetzt (z. B. nach Richtlinie VDI 2083 Blatt 18 [8]). Mit dem MAS-100-NT®-Impaktor können bei einen Volumenstrom von 100 l/min und maximal 10 min Sammelzeit luftgetragene Mikroorganismen aus 1 m³ Luft direkt auf Nährbodenplatten impaktiert werden [9]. Dies geschieht mit ca. 11 m/s relativ sanft und die Mikroorganismen kommen damit sofort in ein Milieu mit ausreichend Nährstoffen und Feuchtigkeit [10; 11]. Der MAS-100 NT® ist dabei weniger zur Sammlung von kleineren Partikeln geeignet; erst für Partikel > 3 µm liegt die physikalische Sammeleffizienz über 50 % [10; 11]. Zudem können mit diesem Verfahren der direkten Impaktion auf Nährböden nur die Anzahl mikroorganismentragender Partikel ermittelt werden. Eine weitere Alternative bietet der Coriolis®-µ-Zyklonsammler. Das System ist bereits in verschiedenen Anwendungsfällen bei Außenluftmessungen erfolgreich eingesetzt worden [12 bis 15] und ermöglicht bei einer Durchflussrate von 100 bis 300 l/min und maximal 10 min Probenahmezeit die Sammlung von luftgetragenen Mikroorganismen aus bis zu 3 m³ Luft in 15 ml Flüssigkeit. Beim Coriolis® gelangen die Partikel verhältnismäßig schonend in den Vortex der Probenahmeflüssigkeit. Der Sammler hat bei einem Volumenstrom von 300 l/min eine physikalische Sammeleffizienz von 62 % für 1 µm große Partikel; für 4 µm große Partikel liegt sie bei 100 % (lt. Herstellerangabe; [16]).
In diesem Beitrag werden Ergebnisse von parallelen Messungen mit einem Coriolis®-µ-Zyklonsammler, einem AGI-30-Impinger und einem MAS-100-NT®-Impaktor im Hinblick auf die Eignung der Verfahren für die Sammlung luftgetragener Mikroorganismen in Umweltbereichen mit geringen Konzentrationen vorgestellt und unter praktischen Gesichtspunkten diskutiert.
2 Material und Methode
Mit den drei Verfahren wurden über ein Jahr verteilt insgesamt 21 Parallelmessungen an verschiedenen Standorten mit zu erwartenden niedrigen Konzentrationen von luftgetragenen Mikroorganismen durchgeführt. Eingesetzt wurden ein AGI-30-Impinger (Ace Glass Inc., Vineland, New Jersey, USA), ein MAS-100 NT®-Impaktor (MBV AG, Microbiology and Bioanalytic, Stäfa, Schweiz) und ein Coriolis®-µ- Zyklonsammler (Bertin Technologies, Montigny-le-Bretonneux, Frankreich), die am Probenahmeort jeweils nebeneinander in 1,5 m Höhe vom Boden in gleicher Orientierung entgegen der Windrichtung an einem Stativ angebracht waren. Wegen der unterschiedlichen Volumenströme der Systeme, aufgrund von Empfehlungen von Herstellern und aus der Literatur sowie unter Berücksichtigung weiterer Effekte, wie Sammelflüssigkeitsverluste beim AGI-30 und Coriolis®-µ sowie Austrocknen oder Einfrieren der Nährböden beim MAS-100 NT® während der Probenahmen, wurden verschiedene Probenahmezeiten gewählt. Diese betrug beim AGI-30-Impinger 30 min (Volumenstrom: 12 l/min), beim MAS-100 NT® 5 min (Volumenstrom: 100 l/min) und beim Coriolis®-µ 15 min (Volumenstrom: 300 l/min). Hierbei ist zu berücksichtigen, dass allein durch die unterschiedlichen Sammelzeiten und die verschiedenen Probenluftvolumina zwangsweise unterschiedliche Ergebnisse zu erwarten sind. Als Sammelflüssigkeit wurde beim AGI-30 und Coriolis®-µ 0,9 % NaCl-Lösung eingesetzt, der MAS-100 NT® impaktiert die luftgetragene Mikroorganismen direkt auf Nährbodenplatten. Bei Temperaturen unter 4 °C wurde eine Heizung für den Impinger eingesetzt, um eine Vereisung zu vermeiden [17]. Direkt im Anschluss an die Probenahme wurden die Proben bei 4 °C für maximal sechs Stunden gelagert. Die während der Probenahme verloren gegangene Menge Sammelflüssigkeit wurde dokumentiert. Die Anzucht der Mikroorganismen erfolgte im Labor auf verschiedenen Selektivnährböden im Zweifachansatz. Ausplattiert wurden jeweils 0,1 und 1 ml der Originalproben. Aufgrund der Anzahl der untersuchten Parameter und der begrenzten Probenflüssigkeitsmenge vor allem beim Coriolis®-µ wurde hier auf eine Sterilfiltration und anschließende Kultivierung der Filter zur Anhebung der Nachweisgrenze verzichtet. Die Kultivierung erfolgte noch am selben Tag im Labor. Die Details sind in Tabelle 1 zusammengefasst.
Nach der Kultivierung wurden die gewachsenen Kolonien auf den jeweiligen Nährbodenplatten gezählt. Ausgewertet wurden jeweils nur die beiden Platten der Verdünnungsstufe, die möglichst zwischen 10 und 150 KBE zeigten. Dabei wurde angelehnt an DIN EN ISO 7218 [18] zwischen Platten mit mindestens 10 bis 150 KBE (Quantifizierung der Anzahl Mikroorganismen ist möglich), mindestens 4 bis 9 KBE (Schätzung der Anzahl Mikroorganismen ist möglich) und weniger als 4 KBE (Mikroorganismus konnte lediglich nachgewiesen werden) unterschieden. Zur Qualitätssicherung wurden bei den Selektivnährmedien randomisiert jeweils fünf Kolonien (wenn vorhanden) von den Nährbodenplatten mithilfe von Gramfärbung, Oxidase- und Katalasetests weiter identifiziert. Schließlich wurde jeweils aus der Anzahl KBE auf den zwei parallelen Nährbodenplatten unter Berücksichtigung des ausplattierten Aliquots, des Volumens der Sammelflüssigkeit, der Sammeldauer und des Volumenstroms das arithmetische Mittel der KBE/m³ berechnet. Beim Impaktor wurde die „positive hole correction“ angewendet [19]. Mit diesem statistischen Verfahren werden Fehler bei der Auswertung minimiert, wenn mehrere bakterientragende Partikel durch dieselbe Impaktordüse auf den Nährboden darunter gelangen und dadurch Kolonien ineinander wachsen, die rein visuell nicht mehr unterschieden werden können.
Zeitgleich mit der Probenahme wurden Luftdruck (PCE-APM 30, Paper Consult Engineering Group oHG, Meschede, Deutschland), Temperatur und Luftfeuchte (Datenlogger Temperatur/Feuchte, Rotronic Messgeräte GmbH, Ettlingen), Windgeschwindigkeit und -richtung (Wind Master Ultrasonic Anemometer 1189-PC, Gill Instruments Ltd., Lymington, England) und UV-Strahlung (PCE-UV-34, UV-A-, UV-B-Messgerät, Paper Consult Engineering Group oHG, Meschede) erfasst.
3 Ergebnisse
Tabelle 2 zeigt für den Coriolis®-µ-Zyklonsammler, den MAS-100®-Impaktor und den AGI-30-Impinger den Anteil aller Nährbodenplatten (jeweils n = 42), auf denen bei der Auswertung im Labor > 10 KBE, 9 bis 4 KBE und 1 bis 3 KBE gewachsen sind.
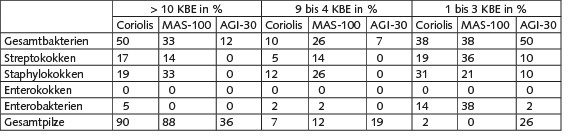
Tabelle 2. Anteil Nährbodenplatten (jeweils n = 42) mit > 10 KBE, 9 bis 4 KBE und 1 bis 3 KBE im Vergleich zwischen Coriolis®-µ-Sammler, MAS-100 NT®- Impaktor und AGI-30-Impinger.
Mit dem Coriolis®-µ konnten im Vergleich zu den anderen Probenahmesystemen insgesamt die meisten Nährbodenplatten zur Quantifizierung kultivierbarer Mikroorganismen genutzt werden. Bei den Gesamtbakterien wurden auf 50 % der Platten mehr als 10 KBE gezählt. Beim MAS-100- NT® waren es 33 %, beim AGI-30-Impinger 12 %. Bei den Streptokokken konnten beim Coriolis®-µ immerhin 17 % der Platten zur Quantifizierung genutzt werden, beim MAS-100-NT® 14 %, beim AGI-30 keine. Mit dem AGI-30 gelang hier auf 10 % der Platten ein Nachweis der Bakterien, ebenso wie bei den Staphylokokken. Die höchste Ausbeute an auswertbaren Probenahmen zeigte der MAS-100-NT® mit 33 und 19 % Nährbodenplatten mit > 10 KBE. Enterokokken konnten mit keinem der eingesetzten Probenahmesysteme nachgewiesen. Enterobakterien konnten nur mit dem Coriolis®-µ in 5 % der Fälle quantifiziert werden. Nachgewiesen wurden sie am häufigsten mit dem MAS-100-NT® auf 38 % der Nährbodenplatten, beim Coriolis®-µ waren es 14 %, beim AGI-30 2 %. Die Gesamtpilze konnten insgesamt am sichersten quantifiziert werden. Beim Coriolis®-µ und dem MAS-100-NT® waren auf ca. 90 % der Nährbodenplatten > 10 KBE, beim AGI-30 auf 36 %.
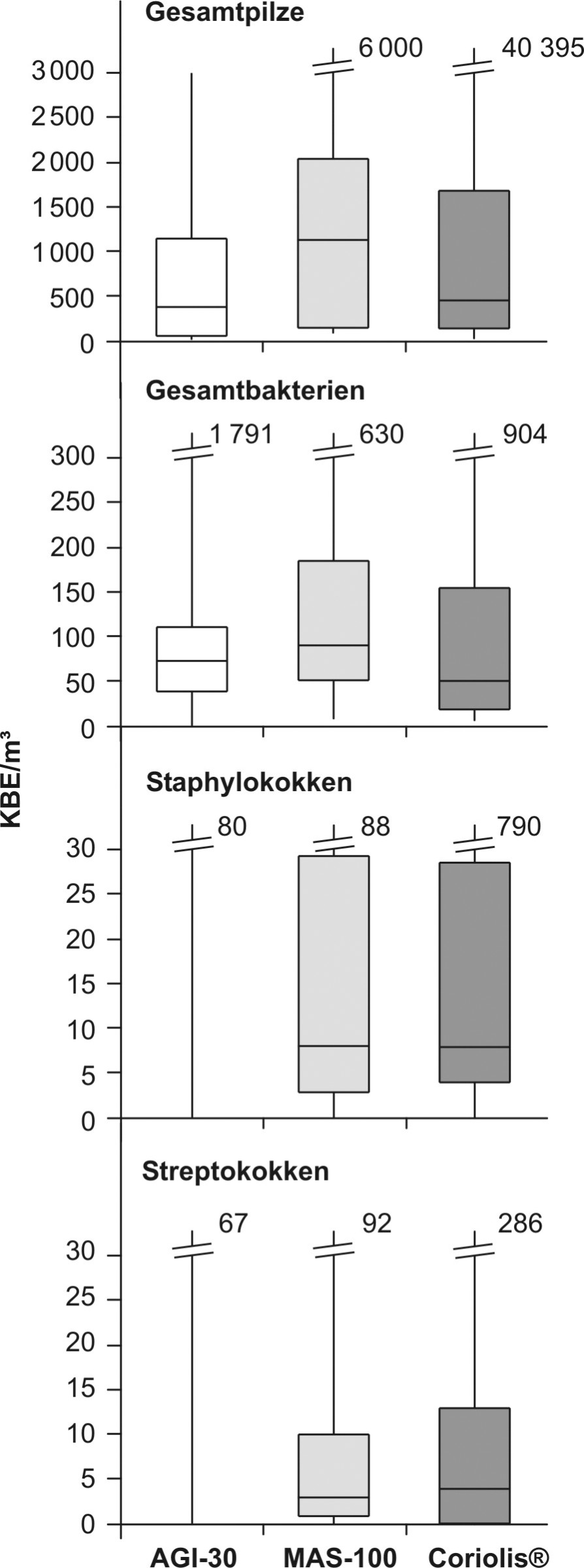
Das Bild zeigt die mit den drei Probenahmesystemen parallel ermittelten Konzentrationen von Gesamtpilzen, Gesamtbakterien, Staphylokokken und Streptokokken.
Enterobakterien wurden nicht dargestellt, da diese nicht ausreichend quantifiziert werden konnten. Enterokokken wurden in keiner Probe gefunden.
Die Konzentrationen für Gesamtbakterien und Gesamtpilze sind beim Einsatz des MAS-100-NT® als Probenahmesystem etwa doppelt so hoch wie bei den anderen beiden Systemen. Die mit dem AGI-30 und dem Coriolis®-µ ermittelten Werte liegen im gleichen Bereich. Bei Staphylokokken und Streptokokken sind dagegen die Werte von MAS-100-NT® und Coriolis®-µ annähernd gleich. Beim AGI-30 konnte hier nicht hinreichend quantifiziert werden.
Bei während der Probenahmen gemessenen Temperaturen zwischen 1 und 19 °C und relativen Luftfeuchten zwischen 50 und 90 % gingen durchschnittlich beim AGI-30 10 % und beim Coriolis®-µ 20 % der Sammelflüssigkeit verloren. Bezieht man den Verlust aber auf das beprobte Luftvolumen, das beim AGI-30 0,36 m³ und beim Coriolis®-µ 3 m³ betrug, ergeben sich pro m³ Luft durchschnittliche Flüssigkeitsverluste von 29 % beim AGI-30 und 7 % beim Coriolis®-µ.
4 Diskussion
Nach den reinen Ergebnissen zeigte der MAS-100-NT® Impaktor im Vergleich zum AGI-30-Impinger und dem Coriolis®-µ-Zyklonsammler die größte Sammeleffizienz. Bei Staphylokokken und Streptokokken lagen MAS-100- NT® und Coriolis®-µ ungefähr gleich auf. Der AGI-30- Impinger zeigte die geringste Sammeleffizienz.
Es ist jedoch unbedingt zu beachten, dass die Probenahmesysteme und auch die mit ihrer Hilfe ermittelten Ergebnisse nur bedingt miteinander vergleichbar sind, da weitere physikalische und biologische, aber auch verfahrenstechnische Faktoren eine wichtige Rolle spielen. Einer der wichtigsten Punkte ist, dass mit Impaktoren wie dem MAS-100-NT® lediglich die Anzahl mikroorganismentragender Partikel erfasst werden kann, da jedes impaktierte Partikel, das kultivierbare Mikroorganismen trägt, auf dem Nährboden nur eine sichtbare Kolonie bildet, unabhängig von der Anzahl der Zellen. Untersuchungen haben gezeigt, dass in der Außenluft die meisten Mikroorganismenzellen auf Partikeln des geometrischen Durchmessers 5 bis 10 µm lokalisiert sind, mit durchschnittlich etwa fünf Zellen pro Partikel [2]. Wären alle kultivierbar, würde beim Einsatz eines Impaktors der tatsächliche Wert entsprechend unterschätzt. In der Außenluft ist dieser Fehler im Verhältnis nicht sehr groß, aber in anderen Bereichen, wie z. B. in der Luft in Tierhaltungen, wo Hunderte Zellen auf Partikeln von 20 bis 100 µm gebunden sind [20], kann er durchaus Zehnerpotenzen betragen [21]. Dagegen können mit dem AGI-30 und dem Coriolis®-µ theoretisch alle in die Sammelflüssigkeit gelangten kultivierbaren Mikroorgansimen quantifiziert werden, da sich diese in der Flüssigkeit idealerweise vereinzeln.
Dass mit dem MAS-100-NT®-Impaktor insgesamt die höchsten Konzentrationen ermittelt wurden, liegt an der im Vergleich zum Impinger und Zyklonsammler höheren biologischen Sammeleffizienz. Während die Mikroorganismen bei der Sammlung mit dem AGI-30 und dem Coriolis®-µ starken physikalischen Wirkungen ausgesetzt sind, gelangen sie im Impaktor relativ zügig in ein für sie schonendes Milieu. Der Tenazitätsverlust ist damit geringer, in der folgenden Kultivierung können mehr Bakterienzellen angezogen und ausgewertet werden. Dies wird auch durch die Ergebnisse zu luftgetragenen Schimmelpilzen gestützt: Bei den gegenüber Umwelteinflüssen relativ robusten Schimmelpilzsporen fallen die Unterschiede zwischen den Verfahren geringer aus.
Beim Impinger und beim Zyklonsammler gehen bereits gesammelte Mikroorganismen über kleine Sammelflüssigkeitströpfchen verloren, die sich durch die starke Luftbewegung im Inneren der Sammler bilden und dann mit dem Luftstrom aus dem System gesaugt werden. Auch der Flüssigkeitsverlust durch Verdunstung kann das Ergebnis direkt durch Veränderung der Verhältnisse im Sammelsystem (z. B. beim Impinger geringer werdender Abstand zwischen kritischer Düse und Flüssigkeitsoberfläche) oder indirekt bei der anschließenden Berechnung der KBE/ml beeinflussen.
Da es sich bei Mikroorganismen um Partikel handelt, sollte zur Vermeidung von Messfehlern unter isokinetischen Bedingungen gemessen werden, d. h. der Probenteilstrom muss gleiche Geschwindigkeit und Richtung haben wie der Hauptluftstrom. Bei geringen Absauggeschwindigkeiten ergeben sich generell höhere Messfehler als bei höheren [22], daher sollten erstere vermieden werden. Bei dieser Untersuchung wurde kontinuierlich die Windrichtung erfasst und die Sammler entsprechend gegen den Wind ausgerichtet. Die mittlere Windgeschwindigkeit betrug dabei 4 bis maximal 6 m/s. Die Einlassgeschwindigkeit der Sammler sollte die mittlere Windgeschwindigkeit nicht unterschreiten. Der AGI-30 liegt mit einer Einlassgeschwindigkeit von 4 m/s genau in diesem Bereich. Der MAS-100-NT® impaktiert die Partikel zwar mit 11 m/s durch 400 Einzeldüsen auf die Nährbodenplatten, der große Durchmesser der Düsenplatte wirkt jedoch gegen den Luftstrom als große Prallfläche und verhindert somit eine Messung unter isokinetischen Bedingungen. Dieser Sammler ist ursprünglich auch für Innenraummessungen ohne nennenswerte Luftbewegung konzipiert worden. Der Coriolis®-µ hat bei einem Volumenstrom von 300 l/min mit rechnerisch 25 m/s die höchste Einlassgeschwindigkeit. Laut Hersteller kann das System zwischen 100 und 300 l/min betrieben werden, was sicherlich auch einen Einfluss auf die Abscheidecharakteristik des Systems haben dürfte. Dies ist bisher jedoch nicht untersucht worden.
Bei dieser Untersuchung lag die Bestimmungsgrenze für eine Quantifizierung der Mikroorganismen für den MAS-100-NT® bei 20 KBE/m³, für den AGI-30 bei 800 KBE/m³ und für den Coriolis®-µ bei 50 KBE/m³. Die untere Nachweisgrenze liegt entsprechend eine Zehnerpotenz niedriger. Beim MAS-100-NT® wäre es theoretisch möglich, durch Verdoppelung der Sammelzeit die Nachweisgrenze noch zu halbieren. Dabei sollte jedoch beachtet werden, dass es bei geringer Luftfeuchte und hohen Temperaturen bereits zu Austrocknungserscheinungen und bei niedrigen Temperaturen zur Vereisung der Nährbodenplatten kommen kann. Beim AGI-30 und Coriolis®-µ dagegen können im Labor statt 1 ml Sammelflüssigkeit auszuplattieren, 10 ml (wie z. B. in der Richtlinie VDI 4252 Blatt 3 [5] empfohlen) oder auch mehr filtriert werden. Dadurch kann bei den beiden Systemen die untere Nachweisgrenze noch um mindestens eine Zehnerpotenz abgesenkt werden. Sollen bei einer Probenahme mehrere Messparameter (Mikroorganismengruppen) erfasst werden, wäre dies aus praktischen Gründen insbesondere beim Coriolis®-µ bei nur maximal 15 ml Sammelflüssigkeit nachteilig, insbesondere wenn eine Doppelbestimmung erfolgen soll. In diesem Fall sollte die Anzahl der Messsysteme vor Ort entsprechend erhöht werden.
5 Schlussfolgerung und Ausblick
Der Coriolis®-µ-Zyklonsammler, der MAS-100-NT®– Impaktor und der AGI-30-Impinger können für die Erfassung von luftgetragenen Mikroorganismen in Umweltbereichen mit geringen Konzentrationen eingesetzt werden, jedoch sollte dies immer in sorgfältiger Abwägung der Fragestellung geschehen. Der AGI-30-Impinger hat trotz der im Vergleich geringeren Sammeleffizienz und der höheren unteren Nachweisgrenze den Vorteil, dass er seit über 60 Jahren als standardisiertes Probenahmesystem in verschiedenen Bereichen eingesetzt wird und entsprechend viele Daten als Referenz vorliegen. Der MAS- 100-NT® zeigte in dieser Untersuchung die höchste Sammeleffizienz und ist aufgrund seiner schonenden Sammelmethode insbesondere für den Nachweis sensitiver Mikroorganismen geeignet. Mit diesem System können jedoch nur die Anzahl kultivierbarer mikroorganismentragender Partikel ermittelt werden. Eine Alternative ist der Coriolis®-µ-Zyklonsammler, bei dem die Mikroorganismen wie auch beim AGI-30 bei der Sammlung weitgehend vereinzelt werden. Mit seiner niedrigen Nachweisgrenze ist er auch für die Sammlung von Mikroorganismen geeignet, die in geringen Konzentrationen in der Luft vorkommen. Dieser Sammler sollte daher intensiver getestet werden, insbesondere die Abscheidecharakteristik bei verschiedenen Volumenströmen, um das System besser einschätzen zu können.
Literatur
- Kolk, A.; van Gelder, R.; Schneider, G.; Gabriel, S.: Mikrobiologische Hintergrundwerte in der Außenluft – Auswertung der BGIA-Expositionsdatenbank MEGA. Gefahrstoffe – Reinhalt. Luft 69 (2009) Nr. 4, S. 130-136.
- Clauß, M.; Springorum, A. C.; Hartung, J.: Jahresverlauf der Hintergrundkonzentrationen verschiedener Gruppen luftgetragener Mikroorganismen in einem urbanen, einem Agrar- und einem Forstgebiet in Norddeutschland. Gefahrstoffe – Reinhalt. Luft 73 (2013) Nr. 9, S. 375-380.
- Blomberg, N.; Springorum, A. C.; Winter, T.; Hartung, J.; Hinz, T.; Öttl, D.; Rieger, M. A.: Beurteilung verschiedener Haltungssysteme für Legehennen aus Sicht des Arbeits- und Umweltschutzes: Belastungen durch luftgetragene Stäube und Mikroorganismen. Abschlussbericht Projekt 05HS012/1–2. Hannover 2009. http://download.ble.de/05HS012_1.pdf
- Köllner, B.; Heller, D.: Bioaerosole im Umfeld von Schweinemastanlagen. Gefahrstoffe – Reinhalt. Luft 66 (2006) Nr. 9, S. 349-354.
- VDI 4252 Blatt 3: Erfassen luftgetragener Mikroorganismen und Viren in der Außenluft – Aktive Probenahme von Bioaerosolen – Abscheidung von luftgetragenen Bakterien mit Impingern nach dem Prinzip der kritischen Düse. Berlin: Beuth 2008.
- Grinshpun, S. A.; Chang, C. W.; Nevalainen, A.; Willeke, K.: Inlet characteristics of bioaerosol samplers. J. Aerosol Sci. 25 (1994) Nr. 8, S. 1503-1522.
- Lödding, H.; Koch, W.; Möhlmann, C.; Kolk, A.: Sammelverhalten von Impingern als Bioaerosolsammler. Gefahrstoffe – Reinhalt. Luft 67 (2007) Nr. 7/8, S. 293-296.
- VDI 2083 Blatt 18: Reinraumtechnik – Biokontaminationskontrolle. Berlin: Beuth 2014.
- MAS-100® Instruction/Reference Booklet. Merck Eurolab, Brussels and EM Science (a.k.a.EMD), Gibbstown, NJ.
- Yao, M.; Mainelis, G.: Investigation of cut-off sizes and collection efficiencies of portable microbial samplers. Aerosol Sci. Technol. 40 (2006), S. 595-606.
- Hottell, K. A.; Kesavan, J.: Characteristics and sampling efficiencies of two impactor bioaerosol samplers: MAS-100® (Microbial Air Monitoring System) and single-stage Andersen viable microbial samplers. Report Nr. ECBC-TN-019, U. S. Army Edgewood Chemical Biological Center, Aberdeen, Proving Ground, Maryland 2004.
- Ahmed, M. F.; Schulz, J.; Hartung, J.: Air samplings in a Campylobacter jejuni positivelaying hen flock. Annals Agricult. Environ. Med. AAEM 20 (2013) Nr. 1, S. 16-20.
- Bellanger, P.; Reboux, G.; Scherer, E.; Vacheyrou, M.; Millon, L.: Contribution of a cyclonic-based liquid air collector for detecting Aspergillus fumigatus by QPCR in air samples. J. Occup. Environ. Hyg. 9 (2012) Nr. 1, S. 7-11.
- Verreault, D.; Gendron, L.; Rousseau, G. M.; Veillette, M.; Massé, D.; Lindsley, W. G.; Moineau, S.; Duchaine, C. D.: Detection of airborne lactococcal bacteriophages in cheese plants. Appl. Environ. Microbiol. 77 (2011) Nr. 2, S. 491-497.
- Conza, L.; Casati, S.; Gaia, V.: Free-living amoebae and Legionella in bioaerosols from composting facilities of southern Switzerland. LEGIONELLA 2009, October 13-17, 2009, Institut Pasteur, Paris, Frankreich.
- Desjonqueres, Q.; Hamdi, S.: Air sampler qualification according to ISO14698 NORM. Controlled Environ. Mag. (2009), S.19-23.
- Springorum, A. C.; Clauß, M.; Hartung, J.: A temperature-controlled AGI-30 Impinger for sampling of bioaerosols. Aerosol Sci. Technol. 45 (2011) Nr. 10, S. 1231-1239.
- DIN EN ISO 7218: Mikrobiologie von Lebensmitteln und Futtermitteln – Allgemeine Anforderungen und Leitlinien für mikrobiologische Untersuchungen. Berlin: Beuth 2014.
- Macher, J. M.: Positive hole correction of multiple jet impactors for collecting viable microorganisms. Am. Indust. Hyg. Assoc. J. 50 (1989) Nr. 11. S. 561-568.
- Clauß, M.; Springorum, A. C.; Hartung, J.: Microscopic analysis of size, structure and amount of particulate bio-aerosols directly sampled from raw and clean gas of an exhaust air bio-washer in a pig fattening unit. Proceedings of the XVth International Congress of the International Society for Animal Hygiene 2014, Vienna, Austria, Vol. 2, S. 789-791.
- Clauß, M.; Hinz, T.: Einfluss der Probenahmebedingungen auf die Höhe von Emissionsfaktoren für luftgetragene Mikroorganismen aus der Nutztierhaltung. Gefahrstoffe – Reinhalt. Luft 74 (2014) Nr. 10, S. 447-453.
- Friedlander, S. K.: Smoke, dust and haze – Fundamentals of aerosol behaviour. Hoboken: John Wiley Sons 1977.
Dr. Marcus Clauß, Dr. Annette Christiane Springorum, Johann Heinrich von Thünen-Institut für Agrartechnologie, Braunschweig.