So werden Kunststoffe biologisch abbaubar gemacht
Forschende der Ruhr-Universität Bochum suchen nach Methoden, mit denen der Kunststoff Styrol biologisch abbaubar wird. Dafür haben sie ein bakterielles Enzym entschlüsselt, das eine wichtige Schlüsselrolle im Styrolabbau erhält.

Das aus Styrol-Bausteinen hergestellte Polystyrolwird zum Beispiel für Verpackungen verwendet. Anders als PET, das inzwischen biotechnologisch hergestellt und auch recycelt werden kann, ist die Herstellung von Polystyrol bislang eine rein chemische Angelegenheit. Auch abgebaut werden kann der Kunststoff (noch) nicht biotechnologisch.
Foto: PantherMedia / Jiri Hera
Polystyrol, hergestellt aus Styrol-Bausteinen, ist einer der am häufigsten verwendeten Kunststoffe, beispielsweise für Verpackungen. Im Gegensatz zu PET, das biotechnologisch produziert und recycelt werden kann, erfolgt die Herstellung von Polystyrol bisher rein chemisch. Auch der Abbau dieses Kunststoffs ist nicht biotechnologisch möglich. Forschende streben eine Änderung an: Ein internationales Team, geleitet von Dr. Xiaodan Li vom Paul Scherrer Institut in der Schweiz und mit Beteiligung von Prof. Dr. Dirk Tischler, Leiter der Mikrobiellen Biotechnologie an der Ruhr-Universität Bochum, hat ein bakterielles Enzym entschlüsselt, das eine zentrale Rolle im Abbau von Styrol spielt. Dies öffnet die Tür für biotechnologische Anwendungen, wie in der Zeitschrift Nature Chemistry vom 14. Mai 2024 berichtet wird.
So wird synthetischer Kautschuk “grün“
Styrol kommt auch in der Umwelt vor
„Jedes Jahr werden mehrere Mio. t Styrol produziert und transportiert“, so Dirk Tischler. „Dabei kommt es auch zur unbeabsichtigten Freisetzung in die Natur.“ Styrol ist jedoch nicht nur durch solche Freisetzungen in der Umwelt präsent; es kommt auch natürlich in Steinkohlenteer vor, tritt in Spuren in ätherischen Ölen einiger Pflanzen auf oder entsteht beim Abbau von Pflanzenmaterial. „Daher ist es gar nicht verwunderlich, dass Mikroorganismen gelernt haben, damit umzugehen oder es sogar zu verstoffwechseln“, so der Forscher.
Kunststoff-Fahrrad geht mit neuem Namen in Serie
Der mikrobielle Styrolabbau ist schnell, aber aufwendig
Bakterien, Pilze und auch der menschliche Körper aktivieren Styrol mit Hilfe von Sauerstoff zu Styroloxid. Styrol ist giftig, Styroloxid jedoch noch schädlicher. Daher ist eine schnelle Verstoffwechselung entscheidend. „In manchen Mikroorganismen und auch im menschlichen Körper wird das so gebildete Epoxid in der Regel mittels Glutathion konjugiert und damit wasserlöslicher gemacht, wodurch ein Abbau, aber auch die Ausscheidung vereinfacht werden“, erklärt Dirk Tischler. „Dieser Weg ist sehr schnell, aber für die Zellen auch sehr teuer. Es muss quasi für jedes Molekül Styroloxid ein Glutathion-Molekül geopfert werden.“
Die Bildung des Glutathion-Konjugats und die mögliche Rückgewinnung von Glutathion sind Gegenstand der aktuellen Forschung in der von der Deutschen Forschungsgemeinschaft geförderten Graduiertenschule MiCon an der Ruhr-Universität. Einige Mikroorganismen haben eine günstigere Alternative entwickelt: Sie verwenden ein kleines Membranprotein, die Styroloxid-Isomerase, um das Epoxid abzubauen.
Einfluss des Strahlmittels auf die Oberflächenqualität
Effizientere Styroloxid-Isomerasen
„Schon nach der ersten Anreicherung der Styroloxid-Isomerase aus dem Bodenbakterium Rhodococcus konnten wir dessen rötlich Farbe wahrnehmen und zeigen, dass dieses Enzym in der Membran gebunden ist“, berichtet Tischler. Während der vergangenen Jahre haben er uns sein Team bereits viele verschiedene Enzyme dieser Familie erforscht und insbesondere in der Biokatalyse eingesetzt. Alle diese Styroloxid-Isomerasen sind katalytisch hoch effizient, sehr schnell und benötigen keine zusätzlichen Stoffe (Co-Substrate). Sie ermöglichen eine schnelle Entgiftung des toxischen Styroloxids im Organismus und bieten zudem ein starkes Potenzial für biotechnologische Anwendungen in der Synthese von Feinchemikalien.
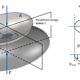
„Um letztere optimieren zu können, ist aber ein Verständnis der Funktion nötig“, erklärt Dirk Tischler. „Das konnten wir in der internationalen Kooperation zwischen Forschenden aus der Schweiz, Singapur, den Niederlanden und Deutschland erheblich voranbringen.“ Das Team konnte zeigen, dass das Enzym als Trimer mit drei identischen Einheiten in der Natur vorkommt. Die Strukturuntersuchungen ergaben zudem, dass zwischen jeder Einheit ein Häm-Cofaktor sitzt, der mit einem Eisenion beladen ist. Das Häm bildet einen wesentlichen Teil der sogenannten aktiven Tasche und ist entscheidend für die Fixierung und Umsetzung des Substrats. Das Eisenion des Häm-Cofaktors koordiniert dabei das Sauerstoffatom des Styroloxids und aktiviert so das Substrat. „Damit konnte eine neue biologische Funktion von Häm in Proteinen umfassend beschrieben werden“, resümiert Tischler.
Optimierung von additiv gefertigten Greifersystemen
Förderung
Die Arbeiten werden teilweise durch die Deutsche Forschungsgemeinschaft innerhalb des Graduiertenkollegs MiCon unterstützt.