Innovativer Produktionsprozess für hochpräzise Polymerrohre
Rohrhalbzeuge aus Kunststoffen sind vor allem für die Medizintechnik von großer Bedeutung. Sie werden unter anderem zur Herstellung von resorbierbaren Gefäßimplantaten genutzt.

Bild 1. Rendering eines vaskulären Gefäßimplantats aus bioresorbierbarem Polymer.
Foto: MeKo Laser Materialbearbeitung.
Werden konventionelle Herstellungsverfahren für Kunststoffrohre angewendet, so limitiert dies die einstellbaren Eigenschaften dieser Halbzeuge. Im Beitrag aus der BMBF-Forschung wird ein innovativer Produktionsprozess vorgestellt, der die Nachteile der bestehenden Verfahren eliminiert und die Fertigung hochpräziser Kunststoffrohre erlaubt.
Medizintechnikindustrie fordert bessere Produktionsmöglichkeiten
Polymerhalbzeuge stellen die Basis zur Herstellung zahlreicher Produkte dar. Insbesondere im Bereich der Medizintechnik gewinnt der Einsatz von tubulären Kunststoffen an Bedeutung. So werden unter anderem Gefäßimplantate, Katheterkomponenten und Herzklappenrahmen aus bioresorbierbaren Polymeren hergestellt (Bild 1) [1]. Für die Produktion der Halbzeuge kommen dabei bisher Verfahren wie die Extrusion zum Einsatz. Die einstellbaren Eigenschaften – wie Festigkeit, Wanddicke und Konzentrizität, sind dabei prozessbedingt limitiert. Daher fordern Medizinproduktehersteller weltweit neue Technologien, mit denen sich tubuläre Polymerhalbzeugen besser erzeugen lassen. Mit dem KMU-Innovativ-Projekt „Prima17“ soll diese Nachfrage bedient werden. Das Ziel des Projekts ist die Entwicklung einer neuartigen Prozessabfolge zur Herstellung hochpräziser Rohrhalbzeuge, wobei die Nachteile der konventionellen Verfahren eliminiert werden sollen.
Extrusion liefert nicht die geforderten präzisen Abmessungen
Die Herstellung von Halbzeugen aus Polymeren wird heutzutage überwiegend mit dem Extrusionsverfahren realisiert. Bei der Extrusion wird ein Granulat in Extruderschnecken plastifiziert und als fließfähige Masse bei einer Temperatur über ihrem jeweiligen Schmelzpunkt durch eine formgebende Düse gepresst. Anschließend erfolgen weitere Veredelungsschritte, um den Kunststoff für den medizinischen Einsatz zu optimieren [2]. Hierzu gehören Nachbearbeitungsschritte zur Festigkeitssteigerung; ebenso das Auftragen von Beschichtungen, um die Oberfläche zu visualisieren oder die Abgabe von Medikamenten zu ermöglichen.
Trotz der weiten Verbreitung des Extrusionsverfahrens sind die einstellbaren Eigenschaften der Kunststoffe limitiert. So können hochpräzise Abmessungen (Außendurchmesser ± 5 µm) und eine hohe Konzentrizität (< 0,01 mm) nicht erreicht werden. Außerdem kommt es bei der Extrusion zu einem hohen Molekularmassenverlust (> 35 %). Da Polymere aus sich wiederholenden Bausteinen (Monomeren), die miteinander verkettet sind, bestehen, werden die Eigenschaften durch die Kettenlänge und somit durch die Molekularmasse definiert. Kommt es zu einer Änderung der Molekularmasse durch den Herstellungsprozess, wird das Einstellen der benötigten Eigenschaften erschwert. Außerdem müssen bei der Extrusion teilweise Additive wie Weichmacher hinzugefügt werden, um das Fließverhalten der Polymermasse zu verbessern. Diese Additive lassen sich später nur sehr schwer entfernen.
Alternative Rohrherstellungsverfahren, die aktuell zur Produktion von Rohrhalbzeugen aus Kunststoffen genutzt werden, zum Beispiel das Gießverfahren und das Tauchbeschichten, führen zu ähnlichen Ergebnissen und können die Nachteile der Extrusion nicht eliminieren.
Neue Prozessfolge liefert exakte Materialkennwerte
Mit dem KMU-Innovativ-Projekt Prima17 wird eine neuartige Prozessabfolge zur Herstellung von tubulären Kunststoffhalbzeugen entwickelt. Dabei werden mehrere Herstellungsschritte durchlaufen: Zunächst wird ein Rohr-Rohling mit kontrollierter Materialzusammensetzung mittels eines Spinn- und Wickelprozesses hergestellt. Im Anschluss wird der Rohling präzise geprüft und auf den nächsten Verarbeitungsschritt vorbereitet.
Das neue Rohrhalbzeug entsteht im abschließenden Verschmelzungsprozess, der unter exakter Atmosphären- und Temperaturregelung stattfindet. Dadurch kann der Kunststoff vor übermäßiger thermischer Belastung geschützt und auf exakte Materialkennwerte eingestellt werden. Mit dem neuen Herstellungsprozess sollen zum einen die Nachteile konventioneller Verfahren eliminiert und zum anderen neue Möglichkeiten zur kontrollierten Integration von Additiven (beispielsweise Medikamente oder Markermaterialien) geschaffen werden.
Zur Erprobung des Verfahrens werden derzeit vorwiegend die beiden in der Medizintechnik weit verbreiteten Polymere „Poly-e-caprolacton“ (PCL) und „Poly-L-lactid“ (PLLA) verwendet. Das Verfahren kann aber auch auf eine Vielzahl anderer Polymere übertragen werden. Die Evaluation der gefertigten Halbzeuge geschieht durch optische, rheologische, chromatographische und spektroskopische Analysemethoden.
Fertigungstechnische Eigenschaften überzeugen die Forscher
Die zuvor erwähnten konventionellen Herstellungsverfahren sind alle geprägt von großen Wandstärketoleranzen (± 15 µm). Dies ist problematisch, da die aus dem Rohrhalbzeug gefertigten Implantate die notwendige Radialkraft auch am unteren Ende der Wandstärkentoleranz aufbringen müssen. Um dies zu erreichen, wird die nominale Wandstärke hochgesetzt. Das hat wiederum negative Auswirkungen auf den späteren Heilungsprozess nach der Implantation.
Auch bei der Weiterverarbeitung der Halbzeuge, beispielsweise durch Laserschneiden, sind große Wandstärkentoleranzen von Nachteil. Die Laserleistung wird stets so eingestellt, dass die Bereiche mit der größten Wandstärke vollständig durchtrennt werden. Ist aufgrund von großen Toleranzen eine höhere Leistung notwendig, führt dies an den Bereichen mit geringer Wandstärke zu einem höheren Energieeintrag in das zu schneidende Material. Dadurch können Schäden auf molekularer Ebene, wie Kettenspaltung (Molekularmassenverlust), entstehen.
Mit der neu entwickelten Prozessabfolge im Projekt Prima17 können Kunststoffrohre mit präziseren Abmessungen und geringeren Toleranzen gefertigt werden. Für ein PCL-Rohr mit einer Wandstärke von 150 µm sind Toleranzen von ± 7 µm realisierbar. Bei einem PLLA-Rohr konnte die Wandstärkentoleranz mit ± 3 µm sogar weiter reduziert werden (Bild 2).
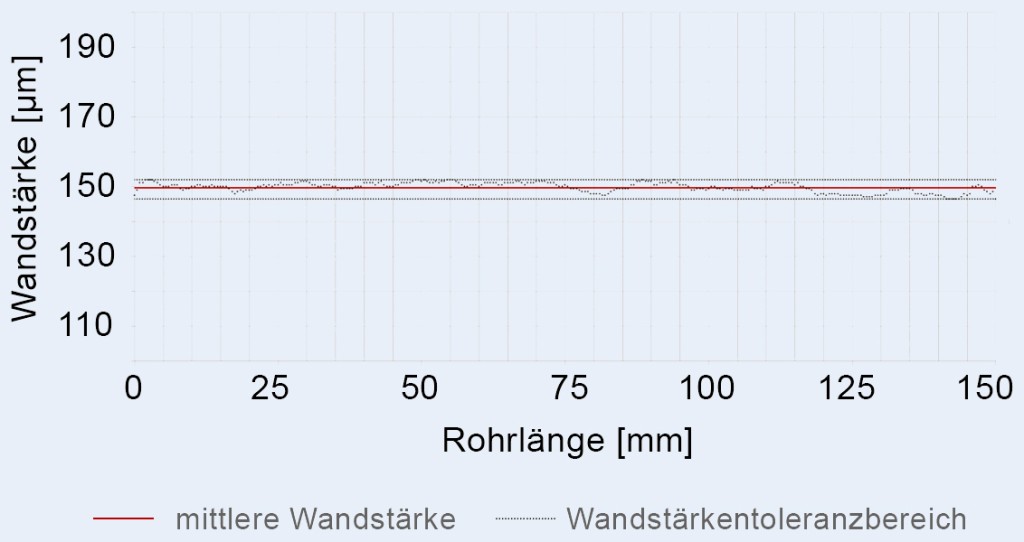
Bild 2. Wandstärkenprofil eines PLLA-Rohrhalbzeuges, das mit dem neu entwickelten Herstellungsverfahren erzeugt wurde.
Foto: Tobias Müller-Edelmann, Daten aus eigener Messung
Ein solch niedriger Wert wurde für polymere Halbzeuge bislang nicht dokumentiert. Die Rohre aus PLLA sind damit sogar präziser als die hochgenauen Metallrohre für Drug-eluting Stents (DES).
Ein weiterer Vorteil des neuartigen Herstellungsverfahrens ist, dass die produzierten Rohre eine sehr hohe Konzentrizität bieten. Dies ist besonders für eine genaue Führung beim Laserschneiden der Halbzeuge wichtig, da hierdurch präzisere Bauteilabmessungen erzielt werden können. Des Weiteren ist der Restlösemittelgehalt im gefertigten Halbzeug sehr niedrig und liegt sogar noch unter dem Wert des verwendeten Ausgangsmaterials. Ein hoher Restlösemittelgehalt kann negative Auswirkungen auf die Biokompatibilität von resorbierbaren Implantaten haben. Daher werden Halbzeuge mit minimalem Restlösemittelgehalt als medizinisches Implantatmaterial bevorzugt.
Auch für die Prototypenfertigung von Rohrhalbzeugen ist das neu entwickelte Verfahren besser geeignet. Da im Vergleich zu extrusionsbasierten Prozessen keine großen Totvolumina vorherrschen und auch keine langen Einfahrzeiten notwendig sind, kann die Kunststoffgranulatmenge individuell abgestimmt werden. Somit sind nur wenige Gramm des Granulats für die Fertigung von Halbzeugen erforderlich und der Investitionsbedarf für die Produktion von Prototypen fällt wesentlich geringer aus.
Neuer Prozess verbessert auch die mechanischen Eigenschaften
Größtes Hindernis bei der Entwicklung von Gefäßimplantaten aus resorbierbaren Kunststoffen sind die im Vergleich zu Metallen unzureichenden mechanischen Eigenschaften. Diese müssen durch dickere Wände kompensiert werden, wodurch wiederum unerwünschte Komplikationen, wie zum Beispiel Stent-Thrombosen, hervorgerufen werden können. Mit dem neuartigen Spinn- und Wickelprozess kann die Festigkeit von Kunststoffrohren durch Orientierung der Molekülketten gesteigert werden. So konnte für PCL eine überdurchschnittliche Zugfestigkeit in Umfangsrichtung von 104,3 MPa erreicht werden (Bild 3).
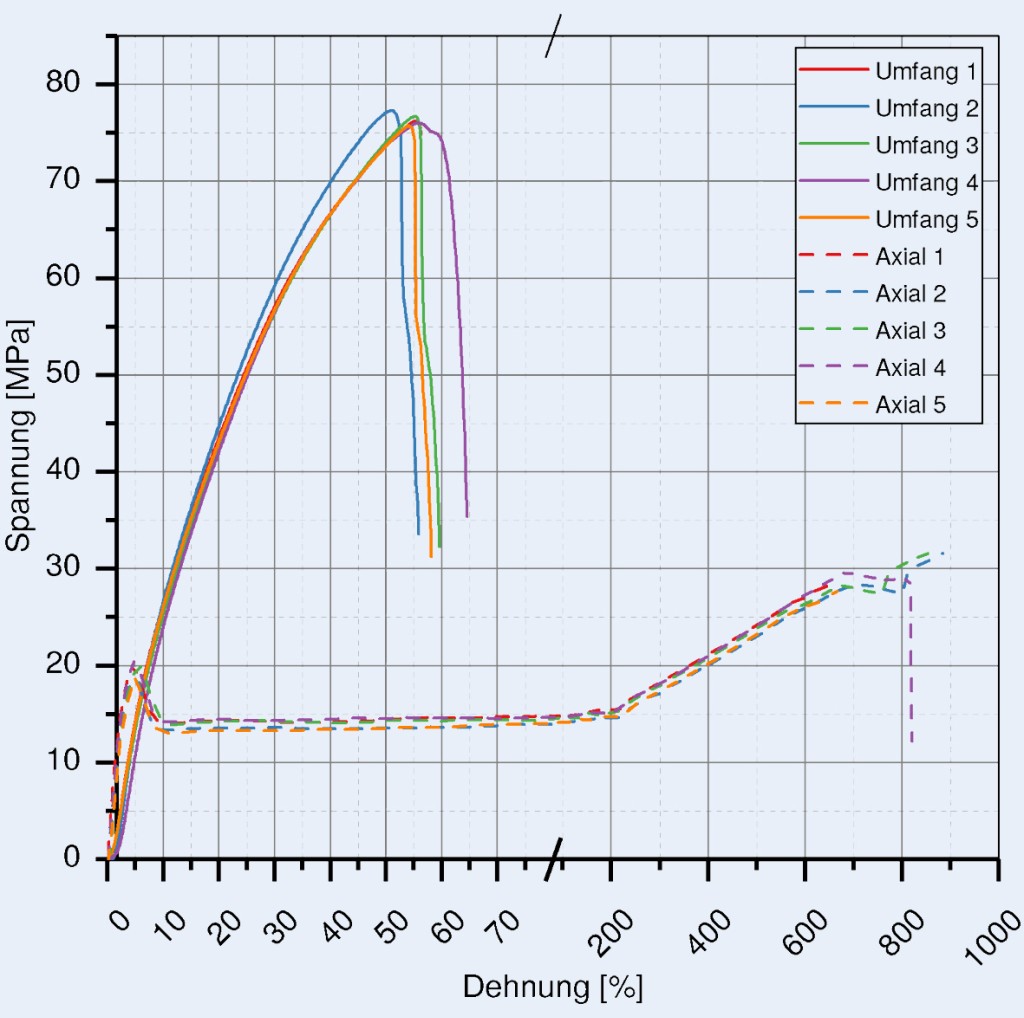
Bild 3. Spannungs-Dehnungs-Diagramm eines PCL-Rohrhalbzeuges, das mit dem neu entwickelten Herstellungsverfahren erzeugt wurde.
Foto: Tobias Müller-Edelmann, Daten aus eigener Messung
Ein wichtiger Einflussfaktor auf das Resorptionsverhalten eines Polymerrohres stellt die Molekularmassenverteilung dar. Bei einem großen, nur schwer kontrollierbaren Molekularmassenverlust, wie bei der Extrusion kommt es zu großen Abweichungen in den Resorptionszeiten, sodass ein Implantat mit größeren Sicherheitsreserven ausgelegt werden muss. Ein geringer Molekularmassenverlust ist daher erstrebenswert. Ein einfaches und sehr gut reproduzierbares Verfahren, um ein Maß für die mittlere Molekularmasse eines Polymers zu erhalten, ist die Bestimmung der inhärenten Viskosität. Für die Messungen wurde jeweils eine Polymerlösung mit einer Konzentration von 1 mg/ml in Chloroform bei 25 °C verwendet. Während bei einem extrudierten PLLA-Rohr die inhärente Viskosität von 3,8 dl/g (Ausgangsmaterial) auf 2,4 dl/g fällt (um circa 36,8 %), sinkt dieser Wert bei der neu vorgestellten Prozessabfolge auf lediglich 3,6 dl/g (um circa 2,7 %). Bei PCL-Rohren konnte ein ähnliches Verhalten beobachtet werden (Reduzierung der inhärenten Viskosität um 1,86 %). Des Weiteren weisen die Rohlinge einen deutlich geringeren Restmonomergehalt als extrudierte Halbzeuge auf. Dies hat einen positiven Effekt auf die Festigkeit, da schon geringe Steigerungen des Restmonomergehaltes zu Festigkeitsverlusten während der Resorption führen [3].
Additive können einfach integriert werden
Kunststoffhalbzeuge, die mit konventionellen Verfahren hergestellt werden, müssen häufig zusätzliche Veredelungsschritte durchlaufen, um medizinisch einsetzbar zu sein. So werden unter anderem Medikamente oder Markermaterialien in Form von Beschichtungen aufgetragen. Diese nachträglichen Behandlungen sind bei der neu entwickelten Prozessabfolge nicht mehr notwendig. Beschichtungen können durch den Spinn- und Wickelprozess direkt bei der Halbzeugherstellung aufgetragen werden. Zusätzlich ist auch die komplette Integration der Additive (Medikamente oder Markermaterialien) in den Rohrrohling möglich. Insbesondere für die Medikamentenabgabe ist dies von großer Bedeutung.
Die komplette Wirkstoffintegration hat gegenüber der Beschichtung den Vorteil, dass das Medikament zum einen kontrollierter und zum anderen über einen deutlich längeren Zeitraum freigesetzt werden kann [4]. Antiproliferative Wirkstoffe, die bei beschichteten Gefäßimplantaten eingesetzt werden, um das Auftreten von Komplikationen nach der Implantation zu verringern, könnten somit gezielter freigesetzt werden und dadurch den Heilungsprozess optimal fördern.
Für den quantitativen und qualitativen Nachweis von Wirkstoffen wurde die Hochleistungs-Flüssigkeitschromatografie (HPLC) sowie die Gel-Permeationschromatografie (GPC) verwendet. Mit der GPC konnte dabei die absolute Wirkstoffmenge im untersuchten Polymerrohr detektiert werden. Die HPLC diente vorwiegend der Analyse der chemischen Wirkstoffstruktur. So konnte ermittelt werden, ob das Medikament weiterhin in seiner ursprünglichen Form oder in einer modifizierten chemischen Struktur vorliegt. Hierzu wurde ein Chromatogramm des Medikaments in seiner reinen Form analysiert und anschließend mit dem Chromatogramm des im Polymerrohr integrierten Wirkstoffes verglichen. In diesem Projekt konnte mit den genannten analytischen Methoden die zerstörungsfreie Integration des antiproliferativen Wirkstoffes Rapamycin in ein PCL-Rohrhalbzeug nachgewiesen werden (Bild 4).
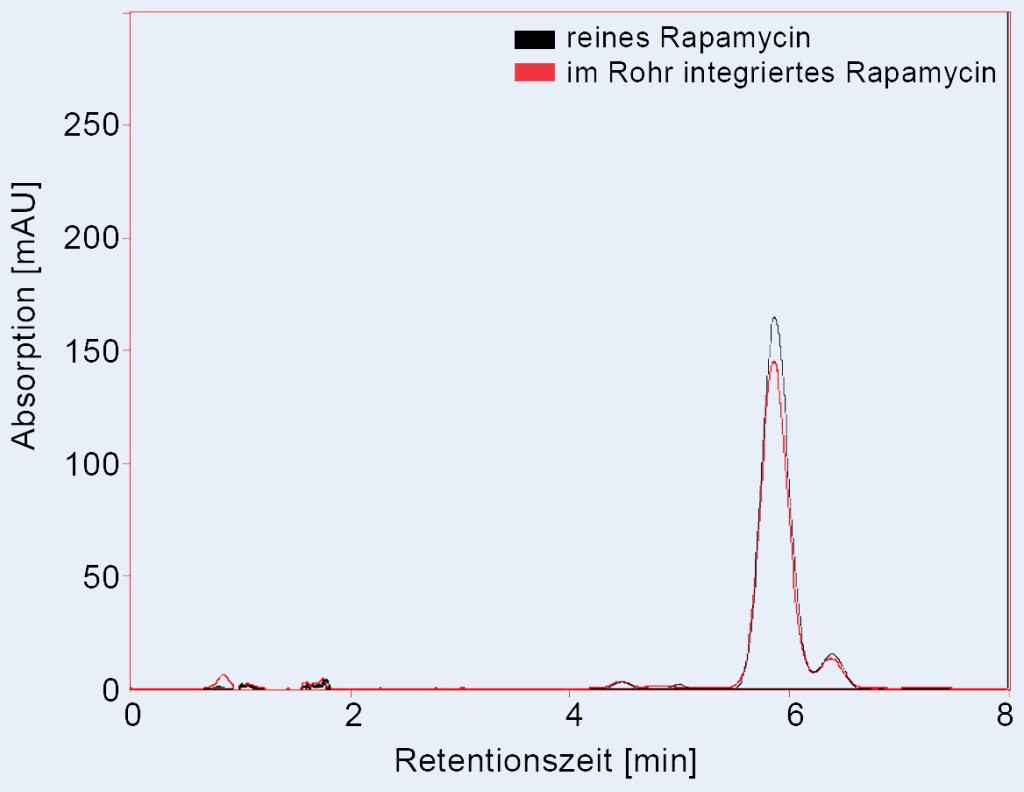
Bild 4. HPLC-Chromatogramm von reinem Rapamycin sowie im PCL-Halbzeug integriertem Rapamycin.
Foto: Tobias Müller-Edelmann, Daten aus eigener Messung
Erste Versuche über das Freisetzungsverhalten von Polymerrohren mit integriertem Rapamycin lieferten ebenfalls vielversprechende Ergebnisse. So konnte festgestellt werden, dass nach einem Zeitraum von 30 Tagen weniger als 10 % des enthaltenen Wirkstoffs freigesetzt wurde. Vergleichbare DES haben in diesem Zeitraum bereits 80 % des Medikaments an ihre Umgebung abgegeben [5]. Für die Validierung dieser ersten Ergebnisse sind jedoch noch weitere umfangreiche Langzeituntersuchungen notwendig (Bild 5).
![Bild 5. Vergleich der Wirkstofffreisetzung eines erzeugten Polymerrohr‧abschnittes mit einem aktuellen Drug-eluting Stent (DES). Foto: Tobias Müller-Edelmann, Daten aus eigener Messung sowie nach Lee et al. (2017) [5]](https://www.ingenieur.de/wp-content/uploads/2020/08/wbk_BMBF_Polymerrohre_Bild-5.jpg)
Bild 5. Vergleich der Wirkstofffreisetzung eines erzeugten Polymerrohr‧abschnittes mit einem aktuellen Drug-eluting Stent (DES).
Foto: Tobias Müller-Edelmann, Daten aus eigener Messung sowie nach Lee et al. (2017) [5]
Verbessertes Anwendungsspektrum und neue Einsatzmöglichkeiten
Mit dem innovativen Produktionsprozess können die Nachteile konventioneller Herstellungsverfahren zur Fertigung von Kunststoffrohren größtenteils eliminiert werden. Dadurch wird das Anwendungsspektrum von Rohrhalbzeugen aus Kunststoffen deutlich erweitert. Die höhere Fertigungspräzision ist vor allem für den medizintechnischen Bereich von Interesse, da Gefäßimplantate mit verbesserten Eigenschaften hergestellt werden können. Des Weiteren eröffnet die Integration von Additiven komplett neue Einsatzbereiche, zum Beispiel die Herstellung von tubulären Drug Delivery Systemen.
www.meko.de
Das Forschungs- und Entwicklungsprojekt Prima17 wird durch das Bundesministerium für Bildung und Forschung (BMBF) im Programm „Innovationen für die Produktion, Dienstleistung und Arbeit von morgen“ (Förderkennzeichen 02P17K090) gefördert und vom Projektträger Karlsruhe (PTKA) betreut. Die Verantwortung für den Inhalt dieser Veröffentlichung liegt bei den Autoren.
Literatur
- Modjarrad, K.; Ebnesajjad, S.: Handbook of Polymer Applications in Medicine and Medical Devices. Elsevier 2013
- Osswald, T. A.: Understanding Polymer Processing. München: Carl Hanser Verlag 2017
- Hyon, S.; Jamshidi, K.; Ikada, Y.: Effects of residual monomer on the degradation of DL-lactide poylmer. Polymer International 46 (1998) 3, pp. 196–202
- Zeng, J.; Xu, X. Chen, X. et al.: Biodegradable electrospun fibers for drug delivery. Journal of Controlled Release 92 (2003), pp. 227–231
- Lee, S.; Bae, I.; Park, D. et al.: Comparison of dextran-based sirolimus-eluting stents and PLA-based sirolimus eluting stents in vitro and in vivo. Journal of Biomedical Materials Research 105 (2017) 1, pp. 301–310
Das könnte Sie auch Interessieren:

Tobias Müller-Edelmann, M. Sc. Dipl.-Chem. Malte Kritzler-Kosch Dr.-Ing. Jakob Dohse MeKo Laser Material Processing in Sarstedt/Hannover.









