Nachhaltiges Wasserstoffperoxid danke neuem Katalysator
Neue Methode für grünes Wasserstoffperoxid: Forschende entwickeln einen effizienten Kohlenstoffkatalysator zur nachhaltigen H₂O₂-Produktion.

Wasserstoffperoxid ist eine der am häufigsten hergestellten Chemikalien. Forschende aus Südkorea haben eine Methode gefunden, es nachhaltiger herzustellen.
Foto: PantherMedia / robertohunger
Wasserstoffperoxid (H₂O₂) zählt zu den wichtigsten Industriechemikalien und wird unter anderem in der chemischen, medizinischen und Halbleiterindustrie genutzt. Die derzeit vorherrschende Herstellungsmethode, das Anthrachinon-Verfahren, hat jedoch einige Nachteile: Sie ist energieintensiv, benötigt teure Palladiumkatalysatoren und erzeugt umweltschädliche Nebenprodukte. Forschende suchen daher nach nachhaltigeren Alternativen.
Ein Forschungsteam unter der Leitung von Dr. Jong Min Kim vom Korea Institute of Science and Technology (KIST) hat nun eine neue Methode entwickelt, die auf elektrochemischer Reduktion von Sauerstoff basiert. Durch den Einsatz eines innovativen mesoporösen Kohlenstoffkatalysators soll es möglich sein, Wasserstoffperoxid effizienter und mit weniger Umweltbelastung herzustellen.
Herausforderungen bisheriger elektrochemischer Verfahren
Die elektrochemische Reduktion von Sauerstoff bietet prinzipiell eine vielversprechende Alternative zur herkömmlichen Produktion. Bisher war dieses Verfahren jedoch mit praktischen Schwierigkeiten verbunden. Dazu zählen die hohen Kosten für hochreinen Sauerstoff und die Tatsache, dass die Reaktion vorwiegend in basischen Elektrolytlösungen abläuft, was die Stabilität des erzeugten H₂O₂ beeinträchtigt. Um diese Hindernisse zu überwinden, entwickelten die Forschenden einen neuartigen Katalysator mit einer speziellen Struktur.
| Eigenschaften von Wasserstoffperoxid |
| Wasserstoffperoxid ist eine blassblaue, in verdünnter Form farblose Flüssigkeit, die sich chemisch aus Wasserstoff und Sauerstoff zusammensetzt. Die Verbindung ist etwas viskoser als Wasser und eine schwache Säure. Aufgrund ihrer starken oxidierenden Wirkung reagiert sie heftig mit Substanzen wie Kupfer, Messing oder Kaliumiodid. Diese Eigenschaften machen Wasserstoffperoxid zu einem effektiven Bleich- und Desinfektionsmittel. In hochkonzentrierter Form wird es zudem als Raketentreibstoff verwendet. |
| Der Umgang mit Wasserstoffperoxid erfordert Vorsicht. Es wirkt stark ätzend, insbesondere als Dampf. Bei Hautkontakt sollten betroffene Stellen sofort mit Wasser gespült werden. In höheren Konzentrationen tötet es Zellen ab, was zu einer weißlichen Verfärbung der Haut führt. Darüber hinaus ist die Verbindung zytotoxisch, also giftig für Zellen, und besitzt eine stark desinfizierende Wirkung gegen viele Mikroorganismen. |
Neuer Katalysator ermöglicht effizientere Produktion
Das Team synthetisierte einen mit Bor dotierten Kohlenstoffkatalysator mit Mesoporen von etwa 20 nm. Dabei wurde Kohlendioxid (CO₂) mit Natriumborhydrid (NaBH₄) und Calciumcarbonat (CaCO₃) umgesetzt. Durch die gezielte Entfernung der Calciumcarbonat-Partikel entstand die poröse Struktur des Katalysators. Diese Struktur bietet eine größere aktive Oberfläche und verbessert die Sauerstoffaufnahme, wodurch die elektrochemische Reaktion effizienter abläuft.
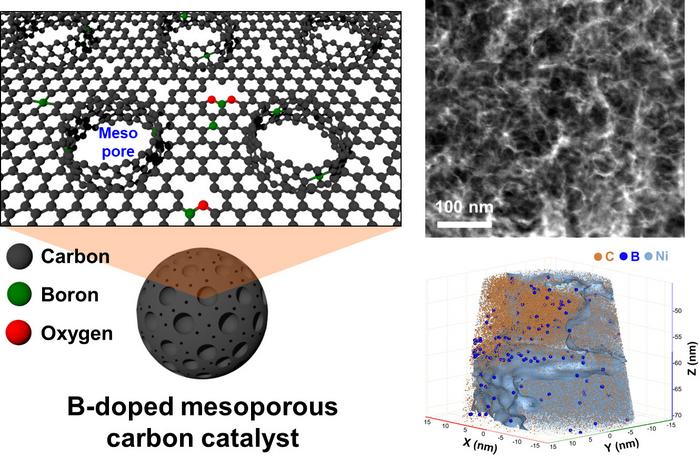
(Links) Schematische Darstellung der Struktur eines porösen Kohlenstoffkatalysators mit Bor-Dotierung auf der Oberfläche und Kohlenstoffwänden, die die Mesoporen bilden. (Rechts) Mesoporöse Struktur und atomare Verteilung von Bor im Kohlenstoffkatalysator, gemessen mit Transmissionselektronenmikroskopie und Rasterkraftmikroskopie.
Foto: Korea Institute of Science and Technology
Experimente und Modellrechnungen zeigten, dass diese spezielle Struktur auch in neutralen Elektrolytlösungen eine hohe katalytische Aktivität ermöglicht. Ein weiterer Vorteil: Selbst bei einer Sauerstoffkonzentration von nur 20 % – wie sie in normaler Luft vorkommt – bleibt die Effizienz des Katalysators erhalten.
| Anwendungen in Industrie und Alltag |
| Bleichmittel und Kosmetik
Wasserstoffperoxid ist eines der bedeutendsten Bleichmittel. Es wird in der Kosmetik zum Blondieren von Haaren und zum Bleichen von Zähnen eingesetzt. In der Papierindustrie spielt es eine zentrale Rolle bei der umweltfreundlichen Zellstoffbleiche. Auch zur Aufhellung von Holz, etwa bei der Restaurierung, findet es Anwendung. |
| Desinfektion in Medizin und Lebensmittelindustrie
Als Desinfektionsmittel wird H₂O₂ unter anderem in der Zahnmedizin verwendet, um Mund- und Rachenraum zu reinigen. Es kommt in Kontaktlinsenreinigern, Hautcremes und zur Entkeimung von Packstoffen zum Einsatz. In der Lebensmittelindustrie wird es zur Sterilisation von PET-Flaschen und Verpackungen genutzt. Hierbei setzt man auf 30%ige bis 35%ige Wasserstoffperoxidlösungen, um aseptische Abfüllprozesse zu gewährleisten. |
| Einsatz in Aquarien und Landwirtschaft
Wasserstoffperoxid wird in Aquarien zur Sauerstoffanreicherung eingesetzt. In einem sogenannten Oxidator wird H₂O₂ in Wasser und Sauerstoffradikale gespalten, um den Sauerstoffgehalt im Wasser zu erhöhen. In der Landwirtschaft dient es zur Desinfektion von Gewächshäusern und zur Sauerstoffanreicherung in Hydrokulturen. |
| Verwendung in der Mikroelektronik und Forensik
In der Mikroelektronik wird Wasserstoffperoxid zur Reinigung von Wafern genutzt. Die sogenannte „Piranha-Lösung“, eine Mischung aus Schwefelsäure und H₂O₂, entfernt Fotolacke und erzeugt hydrophile Oberflächen. In der Forensik kann es zum Nachweis von Blut eingesetzt werden. Bereits im 19. Jahrhundert wurde entdeckt, dass die Peroxidase im Hämoglobin Wasserstoffperoxid zersetzt, ein Effekt, der heute im Kastle-Meyer-Test verwendet wird. |
| Treibstoff für Raketen- und Torpedotriebwerke
Hochkonzentriertes Wasserstoffperoxid wurde in der Raumfahrt und der militärischen Antriebstechnik als Treibstoff oder Sauerstofflieferant genutzt. Es diente als Bestandteil von Steuertriebwerken, etwa bei der Messerschmitt Me 163, und als Oxidationsmittel in Raketen wie der britischen „Black Arrow“. Zudem fand es Anwendung in U-Boot-Torpedos und experimentellen Antrieben, insbesondere im „Walter-Antrieb“, der durch katalytische Zersetzung hohen Dampfdruck erzeugt. Allerdings ist Wasserstoffperoxid hochreaktiv und birgt erhebliche Gefahren, wie der Untergang des russischen U-Boots Kursk im Jahr 2000 zeigt, bei dem vermutlich eine Explosion durch auslaufendes H₂O₂ ausgelöst wurde. |
Industrienahe Bedingungen getestet
In Versuchen konnte das Forschungsteam nachweisen, dass der entwickelte Katalysator eine hohe Produktionseffizienz von über 80 % erreicht – und das unter nahezu kommerziellen Bedingungen. Besonders bemerkenswert ist die erzielte H₂O₂-Konzentration von 3,6 %, die über dem für medizinische Zwecke genutzten Standardwert von 3 % liegt.
„Die mesoporöse Kohlenstoffkatalysatortechnologie, die Sauerstoff aus der Luft nutzt, um Wasserstoffperoxid aus einem neutralen Elektrolyten herzustellen, ist praktischer als herkömmliche Katalysatoren und wird die Industrialisierung beschleunigen“, erklärte Dr. Jong Min Kim von KIST.
Ein Beitrag von:


















