MinFlux: Ein Mikroskop schärfer, als es die Theorie erlaubt
Mit einer neuen Technik lassen sich einzelne Moleküle etwa in Bakterien und Körperzellen beobachten. Das eröffnet neue Möglichkeiten, Krankheiten zu erkennen und Therapien zu entwickeln.

Nobelpreisträger Stefan Hell mit seinem Team: Sie haben das MinFlux-Mikroskop erfunden, mit dem sich die Bewegung von Molekülen in einer Zelle mit einer 100 Mal besseren zeitlichen Auflösung verfolgen lässt als bisher.
Foto: MPI für biophysikalische Chemie
In lebenden Zellen einzelne Moleküle beobachten: Das ist der Traum eines jeden Biologen. Und es könnte helfen, neue Medikamente zu entwickeln sowie Ursachen von Krankheiten zu erkennen. Bisher war das nicht möglich. Elektronenmikroskope bilden zwar scharf genug ab. Das Objekt muss jedoch in eine Vakuumkammer eingesperrt werden. Das überleben Zellen nicht einmal eine Sekunde lang.
Optisches Gesetz überlistet
Jetzt gibt es ein Mikroskop, das Zellen leben lässt, aber dennoch so scharf abbildet, dass sich der Biologentraum erfüllt.
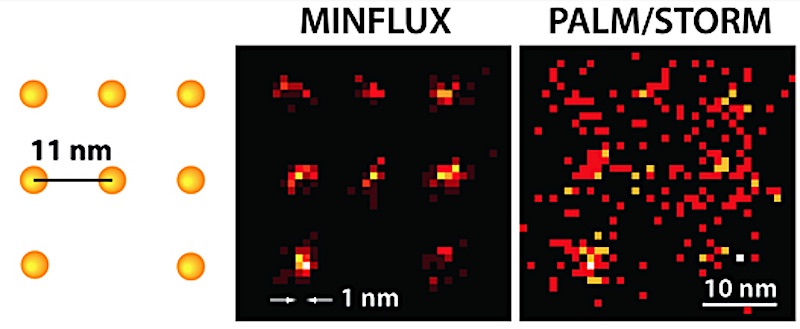
Mit dem MinFlux-Mikroskop können Wissenschaftler erstmals Moleküle optisch voneinander unterscheiden, die nur wenige Nanometer voneinander entfernt sind (links). Während Palm/Storm bei gleicher Molekül-Helligkeit nur ein diffuses Bild liefern kann (rechts, hier in einer Simulation unter idealen technischen Bedingungen), ist die Anordnung der Moleküle mit dem praktisch realisierten MinFlux-Mikroskop (Mitte) klar zu erkennen.
Quelle: K. Gwosch/MPI f. biophysikalische Chemie/
MinFlux – hergeleitet aus dem englischen minimal emission fluxes, also minimale Emissionsflüsse – hat eine mehr als 100 Mal bessere Auflösung als ein Super-Lichtmikroskop. Was eigentlich nicht sein kann.
Ernst Abbe, von 1870 bis 1890 Physikprofessor in Jena und Mitbegründer der deutschen Vormachtstellung in der technischen Optik, formulierte eine Art Gesetz. Danach schaffen Lichtmikroskope eine Auflösung von allenfalls der halben Wellenlänge des sichtbaren Lichts.
Objekte, deren Abstand weniger als 200 Nanometer (millionstel Millimeter) beträgt, können danach nicht mehr unterschieden werden. Sie erscheinen als verwaschener Fleck.
Laserstrahl lässt Moleküle leuchten
Nobelpreisträger (2014) Professor Stefan Hell vom Max-Planck-Institut für biophysikalische Chemie in Göttingen, hat dieses Gesetz mit einigen Tricks ausgehebelt. Er kombinierte zwei Mikroskop-Techniken, die bereits eine höhere Auflösung haben als die, die Abbe als Obergrenze erkannt hatte: Sted, die er selbst entwickelt hat, und Palm/Storm, die unter anderem von seinem Nobelpreiskollegen Robert Eric Betzig, einem amerikanischen Physikprofessor, entwickelt wurde.
In beiden Verfahren werden benachbarte Moleküle mit Hilfe eines feinen Laserstrahls angeregt. Sie beginnen zu fluoreszieren, also zu leuchten. Hell löscht Laserstrahl Nummer eins mit einem zweiten Strahl teilweise wieder aus.
Durch die Kombination beider Strahlen lässt sich die Position des jeweiligen Moleküls präzise bestimmen. Bei Palm/Storm werden Moleküle ebenfalls mit einem Laserstrahl sichtbar gemacht. Die Auflösung ist größer als bei Sted, doch die Position der Teilchen lässt sich nicht präzise erkennen.
Filmaufnahmen aus einem lebenden Bakterium
Durch die Kombination beider Verfahren lässt sich eine noch höhere Auflösung erreichen als bei jedem für sich. Gleichzeitig liegt die Position der jeweils leuchtenden Moleküle fest. Bereits mit Sted lassen sich Echtzeit-Videos aus dem Inneren lebender Zellen aufnehmen.
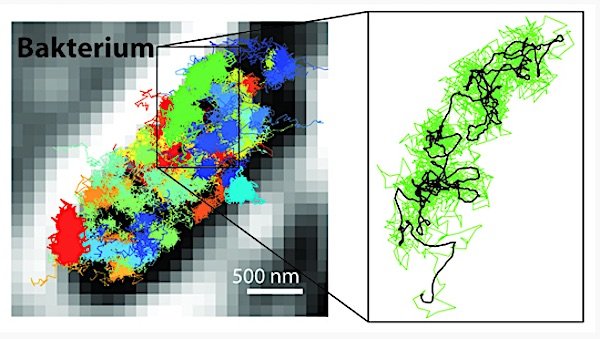
Mit MinFlux lassen sich Bewegungen zeitlich genauer verfolgen als mit der Sted- oder Palm/Storm-Mikroskopie. Dadurch ist es möglich, sehr viel schnellere Bewegungen einzelner fluoreszenzmarkierter Moleküle in einer lebenden Zelle sichtbar zu machen. Links: Bewegungsmuster von 30S-Ribosomen (Bestandteile von Proteinfabriken, farbig) im Bakterium E. coli (schwarz-weiß). Rechts: Bewegungsmuster eines einzelnen 30S-Ribosoms (grün) vergrößert dargestellt.
Quelle: Y. Eilers /MPI f. biophysikalische Chemie
Jetzt ist es möglich, die Bewegung von Molekülen in einer Zelle mit einer 100 Mal besseren zeitlichen Auflösung zu verfolgen. Hell und sein Team haben es geschafft, mit MinFlux die Bewegung von Molekülen in einem lebenden E-coli-Bakterium in bisher unerreichter Zeitauflösung zu filmen.
„Ich bin überzeugt, dass MinFlux-Mikroskope das Zeug dazu haben, eines der grundlegendsten Werkzeuge der Zellbiologie zu werden. Mit diesem Verfahren wird es in Zukunft möglich sein, Zellen molekular zu kartografieren und schnelle Vorgänge in ihrem Inneren in Echtzeit sichtbar zu machen. Das könnte unser Wissen über die molekularen Abläufe in lebenden Zellen revolutionieren“, erklärt Hell. „Und bei der Geschwindigkeit haben wir die Möglichkeiten von MinFlux noch längst nicht ausgereizt“, sagt Yvan Eilers, der zum Hell-Team gehört.
Übrigens lassen sich die Moleküle nicht direkt beobachten. Das Licht, das die angeregten Moleküle abgeben, wird von Fotodetektoren erfasst. Daraus errechnet ein Computer ein Bild – ähnlich wie bei einer Computertomographie.

Mikroskop des Max-Planck-Instituts für Quantenoptik: Forscher beobachten damit millionstel Millimeter kleine Nanoteilchen.
Quelle: Max-Planck-Institut für Quantenoptik
Forscher am Max-Planck-Institut für Quantenoptik (MPQ) in München und der dortigen Ludwig-Maximilians-Universität (LMU) haben einen optischen Verstärker entwickelt, der die Wechselwirkung eines einzelnen Nanoteilchens mit Licht verbessert. Mehr über das Mikroskop aus München können Sie hier nachlesen.
Ein Beitrag von:











