Synthetisches Methan: Mit neuen Katalysatoren wird CO2 zum Wertstoff
Forschende in Bonn und Magdeburg haben unabhängig voneinander Reaktionsbeschleuniger entwickelt, die die Herstellung von Erdgasersatz aus CO2 und Wasserstoff, der mit grünem Strom erzeugt wird, wirtschaftlich machen könnte.

Zwei deutsche Forschungsteams haben unabhängig voneinander Methoden entwickeln, mit denen sich synthetisches Methan wirtschaftlich herstellen lässt.
Foto: PantherMedia / Antonio Scarpi
Mit synthetischem Methan könnten Haushalte, Gewerbe und Industrie zu Umweltmusterknaben werden, ohne dass sie Heizkessel und andere Anlagen austauschen müssten, die heute mit Erdgas betrieben werden. Ähnlich verhält es sich mit synthetischen Treibstoffen. Das Argument der Gegner dieser Lösung, der hohe Energieverbrauch, ist durchaus gerechtfertigt, im Fall Methan allerdings nicht mehr so gravierend.
Forschende an der Universität Bonn haben jetzt einen Katalysator vorgestellt, der Kohlenstoffdioxid (CO2), das aus der Luft abgeschiedene Klimagas, und mit grünem Strom gewonnenen Wasserstoff zu Methan verschmelzen lässt, und das mit einem bisher nicht gekannten Wirkungsgrad.
Volatiler Strom wird zuverlässig
Damit konkurrieren sie nicht nur mit anderen europäischen, amerikanischen und asiatischen Forschungsteams, sondern auch mit Kolleginnen und Kollegen des Max-Planck-Instituts für Dynamik komplexer Systeme in Magdeburg, die ebenfalls einen Prozess zur CO2-Methanisierung entwickelt haben. In beiden Fällen geht es darum, Solar- und Windenergie, die nur bei geeignetem Wetter zur Verfügung stehen, für die Zeit verfügbar zu machen, in der der Wind nicht weht und die Sonne nicht scheint.
Synthetisches Methan könnte in das Erdgasnetz eingespeist werden, aus dem sich beispielsweise Erdgaskraftwerke bedienen, die einspringen, wenn Wind- und Solarenergie nicht ausreichen. Diese würden dann umweltneutral Strom produzieren. Beide Forschergruppen betonen, dass sich ihre Verfahren großtechnisch umsetzen lassen.
Strom soll Wärme und Druck ersetzen
Chemische Reaktionen benötigen Energie, um abzulaufen. Man kann diese zum Beispiel zuführen, indem man die Reaktionspartner erhitzt oder unter hohen Druck setzt oder beides kombiniert. „Wir nutzen dagegen als treibende Kraft Elektrizität“, so Nikolay Kornienko, Professor für Chemie an der Bonner Uni und Spezialist für die Entwicklung von Katalysatoren.
An der Hochschule in der kanadischen Metropole Montreal hat er mit der Entwicklung des Methanisierungskatalysators begonnen. Nach seinem Wechsel in die Bundesstadt hat er sie abgeschlossen. Der höchst komplexe Kat enthält einen Kern aus Kobalt und eine Fülle von angebundenen Fluor-, Kohlenstoff-, Wasserstoff-, Sauerstoff- und Stickstoffatomen.
Gasdiffusions-Elektrode ist die Lösung
„Die Herstellung von Methan – chemisch: CH4 – ist insofern herausfordernd, als dass wir dazu ein Gas mit einer Flüssigkeit reagieren lassen müssen“, sagt er. Die Rede ist von CO2 und Wasser (H2O). Die Forscher nutzen eine so genannte Gasdiffusions-Elektrode, um diese beiden Partner zusammenzubringen. Bei der Reaktion müssen die beiden Sauerstoff-Atome vom Kohlenstoff-Atom abgetrennt und durch vier Wasserstoff-Atome ersetzt werden, die dem Wasser entnommen werden.
Mehrere Reaktionen fast gleichzeitig
Im Bonner Reaktor laufen gleichzeitig und in kurzen Abständen mehrere Reaktionen ab. Dass Wasser wird in Wasser- und Sauerstoff aufgespalten, das CO2 in Kohlenstoff und Sauerstoff. Sauerstoff, so wertvoll er auch für das Leben auf der Erde ist, stört in diesem Fall nur. Er muss auf Abstand gehalten werden, denn jedes Kohlenstoffatom soll ja vier Wasserstoffatome aufnehmen, um Methan zu bilden. Der Katalysator schwächt die Bindungen zwischen Wasserstoff und Sauerstoff sowie zwischen Kohlenstoff und Sauerstoff und assistiert zudem bei der erwünschten Anlagerung des Wasserstoffs an den Kohlenstoff.
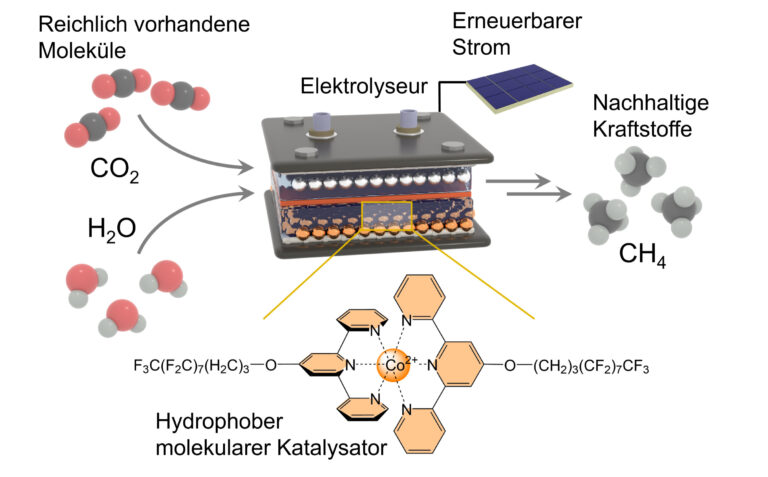
So funktioniert das Bonner Verfahren: Der hydrophobe molekulare Katalysator (unten) – hält die H2O-Moleküle im Elektrolyseur (oben) vom aktiven Zentrum fern. Zugleich entreißt er Wassermolekülen Wasserstoff-Atome und schafft diese zum aktiven Zentrum, wo sie mit dem Kohlenstoff-Atom zu Methan reagieren.
Foto: Nikolay Kornienko
Katalysator noch nicht industrietauglich
Die Effizienz des Prozesses liegt bei mehr als 80 %; bei der Reaktion entstehen also wenig unerwünschte Nebenprodukte. In seiner jetzigen Zusammensetzung eignet sich der Katalysator allerdings nicht für die Herstellung von Methan in großem Maßstab. „Die Reaktionsprinzipien, die wir in ihm verwirklicht haben, lassen sich aber auch mit anderen Katalysatormaterialien realisieren, die sich großtechnisch einsetzen lassen“, sagt Kornienko.
Hitze muss gebändigt werden
Das Magdeburger Team setzt statt Kobalt das weitaus weniger seltene Nickel ein. Das geht allerdings nicht ohne Schutzmaßnahmen, denn der Nickelkatalysator wird zerstört, wenn er einer Temperatur von mehr als 550 Grad Celsius ausgesetzt wird. Die wird aber bei der Reaktion von Wasserstoff und CO2 regelmäßig überschritten. Aus diesem Grund verpasste das Team um MPI-Direktor Kai Sundmacher, der auch den Lehrstuhl für Systemverfahrenstechnik an der Otto-von-Guericke-Universität Magdeburg innehat, den Nickelpartikeln eine poröse Hülle.
Die Reaktanden, also CO2 und Wasserstoff, müssen diese Hülle passieren, um das Nickel zu erreichen. Dort angekommen sorgt der Katalysator dafür, dass beide sich vereinigen und Methan entsteht. Dieses entweicht dann wiederum durch die poröse Hülle. Mit diesem Trick verlangsamen die Forscher die Reaktion, was wiederum den Temperaturanstieg bremst. Es wird nie heißer als 480 Grad.
Das Magdeburger Verfahren ist besonders gut für die Verarbeitung von grünem Strom geeignet. Wetterbedingte Pausen bei der Wasserstoffversorgung steckt eine solche Anlage locker weg. Im institutseigenen Technikum hat das Team das Verfahren bereits erprobt.
Ein Beitrag von:













