Direkt ins Gehirn: Wirkstoffabgabe durch Ultraschall und Mikroblasen
Mikroblasen ermöglichen gezielten Medikamententransport ins Gehirn – Forschende der ETH Zürich entschlüsseln den Wirkmechanismus.
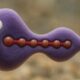
Die Mikroblasen und das Medikament (blaue Kugeln) werden durch die Blutgefässe transportiert. Aufgrund der Einwirkung von Ultraschall erzeugen die Blasen Mikrojets, die es dem Medikament ermöglichen, die Gefässwände zu durchdringen.
Foto: Sonia Monti / ETH Zürich
Die gezielte Behandlung von Hirnerkrankungen wie Alzheimer, Parkinson oder Hirntumoren stellt die moderne Medizin vor enorme Herausforderungen. Das zentrale Problem ist die sogenannte Blut-Hirn-Schranke. Diese natürliche Barriere schützt das empfindliche Gehirn vor Schadstoffen, lässt aber auch viele potenziell wirksame Medikamente nicht passieren. Somit bleibt der direkte Zugang zu erkrankten Hirnregionen oft verwehrt.
Forschende weltweit suchen deshalb nach neuen Ansätzen, um diese Schranke sicher und effizient zu überwinden. Einer dieser Ansätze kommt von der ETH Zürich. Dabei geht es um die Nutzung von Mikroblasen, die ganz gezielt durch Ultraschall aktiviert werden.
Inhaltsverzeichnis
So funktioniert das mit den Mikroblasen
Mikroblasen sind winzige Gasbläschen, die kleiner sind als rote Blutzellen. Sie bestehen aus einem gasgefüllten Kern, der von einer schützenden Hülle aus Lipiden (Fettmolekülen) oder Polymeren umgeben ist. Diese stabilisierende Schicht sorgt dafür, dass die Mikroblasen im Blutkreislauf intakt bleiben. Nach ihrer Injektion in die Blutbahn zirkulieren sie, bis sie durch gezielte Ultraschallwellen aktiviert werden.
Wird Ultraschall auf eine bestimmte Region im Körper gerichtet, beginnen die Mikroblasen zu schwingen. Diese Schwingungen können so intensiv werden, dass die Mikroblasen die Zellmembranen der umliegenden Gefäße punktuell durchlässig machen. Dabei entstehen winzige Poren in der Membran der Gefäßwandzellen, durch die Medikamente gezielt eindringen können – ohne das umliegende Gewebe zu beschädigen.
Züricher Forschende machen den Mechanismus sichtbar
Wie genau diese Poren in der Zellmembran entstehen, war lange unklar. Forschende der ETH Zürich unter der Leitung von Professorin Outi Supponen am Institut für Fluiddynamik haben diesen Mechanismus nun erstmals sichtbar gemacht. In ihrer bahnbrechenden Studie entwickelten sie eine spezielle Beobachtungstechnik, die bisher nicht mögliche Einblicke in diesen komplexen Prozess ermöglicht.
Das Team konstruierte ein hochspezialisiertes Mikroskop mit 200-facher Vergrößerung, das den Blickwinkel revolutionierte: Anstatt die Mikroblasen nur von oben zu beobachten – wie es bei herkömmlichen Mikroskopen der Fall ist – wurde der Prozess erstmals von der Seite sichtbar gemacht. Gekoppelt mit einer Hochgeschwindigkeitskamera, die bis zu zehn Millionen Bilder pro Sekunde aufnimmt, konnten die Forschenden die ultraschnellen Bewegungen der Mikroblasen im Detail erfassen.
Ein ausgeklügeltes Experiment zur Simulation der Blut-Hirn-Schranke
Um die natürlichen Bedingungen im menschlichen Körper so genau wie möglich zu imitieren, entwickelten die Forschenden ein In-vitro-Modell. Dabei wurden Gefäßwandzellen auf einer speziellen Kunststoffmembran gezüchtet. Diese Membran diente als künstliche Blutgefäßwand. In einem durchsichtigen Behälter, gefüllt mit einer Kochsalzlösung und einem Modellmedikament, stiegen die gasgefüllten Mikroblasen automatisch auf und kamen in Kontakt mit den Zellen.
Ein gezielter Ultraschallimpuls von nur wenigen Mikrosekunden Dauer versetzte die Bläschen in Schwingung. Dabei veränderten sich die Blasen: Sie begannen, ihre kugelförmige Gestalt zu verlieren und bildeten wellenartige Muster aus, deren Spitzen nach innen und außen schwingen.
Mikrojets bewegen sich mit 200 km/h
Die entscheidende Entdeckung: Ab einem bestimmten Ultraschalldruck – etwa 100 kPa – verformen sich die Blasen so stark, dass die nach innen gerichteten Spitzen tiefer einsinken und dabei starke Flüssigkeitsstrahlen, sogenannte Mikrojets, erzeugen. Diese Strahlen durchdringen die Blase und treffen mit hoher Geschwindigkeit auf die Zellmembran.
Diese Mikrojets bewegen sich mit einer Geschwindigkeit von bis zu 200 km/h. Der Effekt ist vergleichbar mit einem präzisen Nadelstich: Die Zellmembran wird punktuell geöffnet, ohne die Zelle zu zerstören. Dies ermöglicht es, Medikamente gezielt in die Zelle einzuschleusen. Besonders bemerkenswert ist, dass dieser Mechanismus die Mikroblase nicht zerstört – sie bleibt intakt und kann den Vorgang bei jedem neuen Ultraschallzyklus wiederholen.
Anwendung mit geringem Risiko
Ein weiterer entscheidender Vorteil dieser Technologie ist laut Forschungsteam der niedrige erforderliche Ultraschalldruck. „Dieser Ausstoßmechanismus wird bereits bei einem Druck von etwa 100 kPa ausgelöst“, erklärt Supponen. Dies entspricht in etwa dem atmosphärischen Luftdruck, dem wir täglich ausgesetzt sind. Die Anwendung birgt also ein geringes Risiko und könnte daher auch für sensible Behandlungsbereiche wie das Gehirn besonders geeignet sein.
Die Erkenntnisse der ETH Zürich liefern nicht nur wichtige Einsichten in die physikalischen Grundlagen dieses Verfahrens, sondern eröffnen auch neue Perspektiven für dessen praktische Anwendung. Die gezielte Kombination aus Ultraschallfrequenz, Druck und Mikroblasengröße ist entscheidend, um Medikamente präzise und sicher in das gewünschte Gewebe zu transportieren.
Zusätzlich können die Mikroblasen speziell für bestimmte Ultraschallfrequenzen beschichtet werden, um die Bildung der Mikrojets zu erleichtern. Dies verbessert die Effizienz des Therapieverfahrens und ermöglicht eine gezieltere Steuerung der Medikamentenabgabe. Mit dem neuen Laboraufbau können auch andere Mikroblasenformulierungen getestet werden, was die Entwicklung maßgeschneiderter Therapieansätze weiter vorantreibt.
Neue Hoffnung für die Behandlung schwer zugänglicher Hirnerkrankungen
Die Möglichkeit, Medikamente gezielt und minimalinvasiv ins Gehirn zu transportieren, eröffnet neue Chancen für die Behandlung komplexer Erkrankungen. Vor allem bei neurodegenerativen Krankheiten wie Alzheimer oder Parkinson sowie bei Hirntumoren könnte diese Technologie die Therapie revolutionieren.
„Unsere Arbeit klärt die physikalischen Grundlagen der gezielten Medikamentenverabreichung durch Mikroblasen und hilft uns, Kriterien für deren effektiven und sicheren Einsatz zu definieren“, betont Supponen. Die Forschenden sehen großes Potenzial in der Weiterentwicklung dieser Methode, insbesondere im Hinblick auf die Verbesserung der Patientensicherheit und die Minimierung von Nebenwirkungen.
Ein Beitrag von: