Corona: EU-weit erstes Medikament zugelassen
Ein Fachausschuss der Europäische Arzneimittel-Agentur (EMA) hat empfohlen, Remdesivir gegen Lungenentzündungen durch SARS-CoV-2 zuzulassen. Das ist bisher über den Wirkstoff bekannt – und diese Fragen sind noch offen.
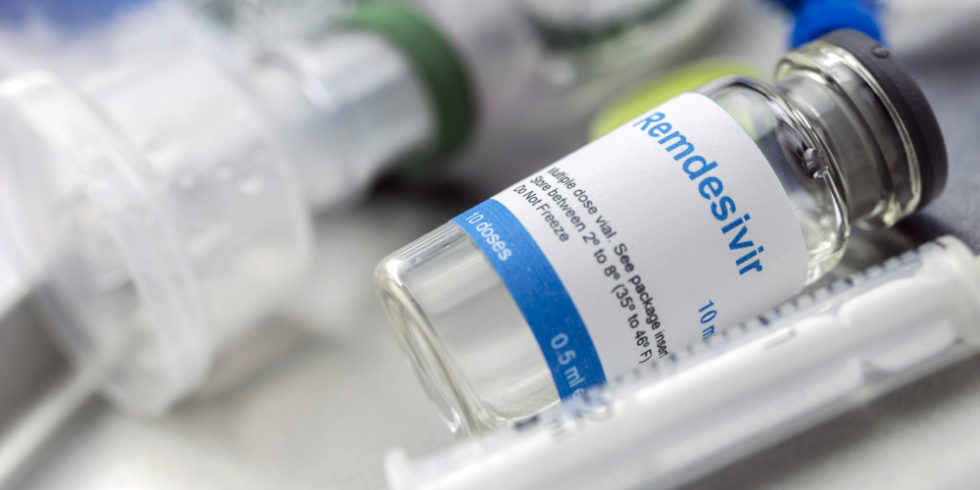
Wird es das erste offiziell zugelassene Medikament gegen Corona in der EU?
Foto: panthermedia.net/digicomphoto
Seit Beginn der SARS-CoV-2-Pandemie haben Forscher weltweit etliche bereits synthetisierte Moleküle auf ihre Wirkung gegen das neuartige Coronavirus hin erforscht. Sie durchsuchten Wirkstoffbibliotheken mit Algorithmen der künstlichen Intelligenz. Diese Strategien sparen – verglichen mit der Synthese neuer Moleküle – viel Zeit. Und letztlich brachten sie den gewünschten Erfolg.
Ein Unterausschuss der Europäische Arzneimittel-Agentur (EMA) hat Remdesivir zur Zulassung bei Covid-19 empfohlen. Das endgültige Votum der EMA wird in Kürze erwartet und ist nur noch eine Formsache. Alle Fakten im Überblick.
Corona: Was ist Remdesivir?
Remdesivir ist ein Arzneistoff mit virustatischen Eigenschaften. Er hemmt die virale RNA-Polymerasen, also Enzyme, ohne die sich Viren nicht vermehren können. Das Molekül kommt aus den Labors von Gilead Sciences.
Es wurde aber keineswegs als Therapie gegen das neuartige Coronavirus entwickelt. Vielmehr sollte Remdesivir gegen Ebolaviren eingesetzt werden. Doch eine zwischen November 2018 und August 2019 durchgeführte Studie brachte nicht die erwünschten Nachweise zur Wirksamkeit. Antikörper gegen Ebola schnitten besser ab. Und so endete dieser Teil der Forschung. Dass Remdesivir gegen Viren wirkt, stand aufgrund von Labor- und Tierexperimenten aber außer Frage.
Wie lief das beschleunigte Zulassungsverfahren der EMA ab?
Nachdem sich wissenschaftliche Hinweise auf die Wirkung von Remdesivir gegen SARS-CoV-2 gehäuft hatten, entschloss sich die EMA zu einem besonderen Verfahren, Rolling Review genannt. Sie wertete regelmäßig wissenschaftliche Publikationen aus. Ansonsten müssen Hersteller Dossiers mit klinischen Daten bei der Behörde einreichen. Die Rolling Review spart Zeit.
Daten kamen hauptsächlich vom US-amerikanischen Nationalen Institut für Allergie und Infektionskrankheiten (NIAID), aber auch aus weiteren Quellen. Dabei wurde Remdesivir mit wirkstofffreien Präparaten, den Placebos, verglichen.
Wer profitiert von Remdesivir – und wer nicht?
Bewertet wurde die Wirksamkeit bei 1.000 Patienten, die aufgrund von Covid-19 im Krankenhaus behandelt werden mussten. Sie erhielten Remdesivir oder Placebo. Erfasst wurde, wie schnell sich die Erkrankten erholten, also aus dem Krankenhaus entlassen werden konnten, keinen Sauerstoff oder keine künstliche Beatmung mehr benötigten.
Insgesamt zeigte die Studie, dass sich mit Remdesivir behandelte Patienten nach etwa elf Tagen erholten, verglichen mit 15 Tagen bei Patienten, denen Placebo verabreicht wurde. Dieser Effekt wurde bei Personen mit leichter bis mittelschwerer Erkrankung nicht beobachtet: Die Zeit bis zur Genesung betrug sowohl für die Remdesivir-Gruppe als auch für die Placebo-Gruppe fünf Tage. Bei Patienten mit schwerer Erkrankung, das waren 90% in der Kohorte, waren es zwölf Tage in der Remdesivir-Gruppe und 18 Tage in der Placebo-Gruppe. Patienten, die bereits eine mechanische Beatmung oder eine extrakorporale Membranoxygenierung (ein Verfahren zur Anreicherung des Blutes mit Sauerstoff) erhielten, hatten nichts von dem Medikament.
Generell fehlen Daten zur Frage, wie viele Patienten innerhalb von 28 Tagen gestorben sind. Diese müssen vom Hersteller noch nachgereicht werden. Die EMA spricht von einer „bedingten Genehmigung“. Das heißt: Nach der Zulassung sind weitere Informationen bis Ende Dezember 2020 vorzulegen.
Was wird Remdesivir kosten?
Bislang hat sich der Hersteller nur zu Preisen in den USA geäußert. Verschiedene Medien berichten über 3.120 US-Dollar (etwa 2.764 Euro) pro Patient für Privatversicherte und 2.340 US-Dollar (etwa 2.073 Euro) pro Patient bei den staatlichen Versicherungen Medicaid und Medicare. Preise in einer ähnlichen Größenordnung sind für Deutschland zu erwarten. Aufgrund älterer Gerichtsurteile sind Versicherungen in Deutschland verpflichtet, die Kosten zu übernehmen – denn es gibt Belege für die Wirksamkeit, aber keine Alternativtherapien.
Gibt es genug Remdesivir für alle?
Angesichts der weltweiten SARS-CoV-2-Pandemie bleibt zu klären, welche Mengen an Remdesivir geliefert werden könnten. Auf seiner Website nennt der Hersteller Dosen für mehr als 190.000 Patienten bis Ende Juni, zwei Millionen bis Dezember 2020 und „einige Millionen“ im Laufe des nächsten Jahres. Der Bedarf lässt sich kaum abschätzen – nicht jeder Patient mit Covid-19 profitiert, wie die Studien gezeigt hatten.
Das scheint Amerikas Präsidenten Donald Trump zu wenig zu sein. US-Medien berichten jetzt, seine Regierung habe auf die Schnelle einen Vertrag mit Gilead paraphiert. Es geht um 500.000 Behandlungsdosen bis September 2020.
Mehr zum Thema Covid-19:
Ein Beitrag von: