Gibt es künftig maßgeschneidertes Knorpelgewebe aus dem 3D-Drucker?
An der Technischen Universität Wien wurde eine neue Methode zur Produktion von künstlichem Gewebe entwickelt. Das Forscherteam verwenden hierfür Zellen in präzise gefertigten Mikrostrukturen, die mittels 3D-Druckverfahren hergestellt werden.
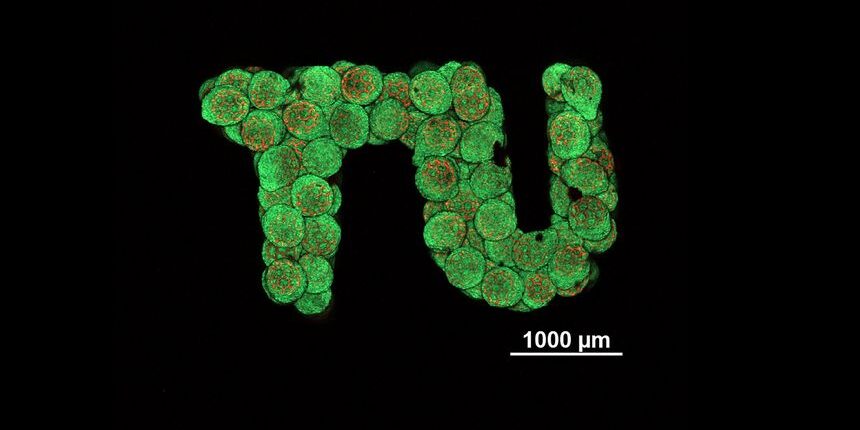
Aus den mit lebenden Zellen besiedelten Kügelchen lässt sich prinzipiell jede beliebige Gewebeform herstellen - auch ein TU-Logo.
Foto: TU Wien
Ist es möglich, Gewebe im Labor nach einem vorgegebenen Plan wachsen zu lassen, um damit zum Beispiel verletzten Knorpel im Körper zu ersetzen. Die TU Wien hat einen ganz neuen Ansatz entwickelt, der sich von anderen Methoden, die woanders auf der Welt erprobt werden, grundsätzlich unterscheidet. Mit Hilfe eines Präzisions-3D-Druckverfahrens werden winzige, poröse Kügelchen aus einem biologisch verträglichen und abbaubaren Kunststoff hergestellt und anschließend mit Zellen besiedelt. Diese Kügelchen lassen sich zu jeder gewünschten Form zusammenfügen, woraufhin die Zellen der verschiedenen Komponenten nahtlos zu einem einheitlichen, lebendigen Gewebe verschmelzen. Gerade bei Knorpelgewebe galt dies bislang als besonders schwierig.
Normalerweise wenig Kontrolle über die Form
Dipl.-Ing. Oliver Kopinski-Grünwald vom Institut für Werkstoffwissenschaften und Werkstofftechnologie der TU Wien ist einer der Autoren der aktuellen der Studie. Er formuliert die Herausforderungen bei der Entwicklung von Knorpelzellen folgendermaßen: „Knorpelzellen aus Stammzellen zu kultivieren, ist dabei gar nicht die größte Herausforderung. Das Hauptproblem ist, dass man normalerweise wenig Kontrolle darüber hat, welche Form das entstehende Gewebe dann annimmt. Das liegt auch daran, dass solche Stammzellklumpen im Lauf der Zeit ihre Form verändern und oft schrumpfen.“
Das Forschungsteam der Technischen Universität Wien hat einen innovativen Ansatz gewählt, um winzige käfigartige Strukturen mit einer speziellen 3D-Laserdrucktechnik zu entwickeln. Diese Strukturen, die wie Mini-Fußbälle aussehen und nur einen Drittel Millimeter Durchmesser haben, dienen als Stützgerüste. Durch das Zusammenfügen kompakter Bausteine lassen sich beliebige Formen erzeugen. In diese Minikäfige werden Stammzellen eingebracht, die das kleine Volumen schnell vollständig ausfüllen.
„Wir können auf diese Weise also erstmals zuverlässig Gewebe-Konstrukte erzeugen, in denen die Zellen ganz gleichmäßig verteilt sind und die Zelldichte sehr hoch ist. Mit bisherigen Ansätzen wäre das nicht möglich“, erklärt Univ.Prof. Aleksandr Ovsianikov, Leiter der Forschungsgruppe 3D Printing and Biofabrication an der TU Wien.
Differenzierte Stammzellen werden zu Knorpelgewebe
Das Team verwendete differenzierte Stammzellen, die bereits so programmiert sind, dass sie sich zu einem bestimmten Gewebetyp entwickeln – in diesem Fall zu Knorpelgewebe. Diese Zellen bieten aufgrund ihrer spezialisierten Funktionen ein hohes Potenzial für medizinische Anwendungen. Die Herausforderung beim Aufbau größerer Knorpelgewebestrukturen besteht darin, dass Knorpelzellen eine dichte extrazelluläre Matrix bilden. Diese Matrix, ein netzartiges Gewebe zwischen den Zellen, erschwert es einzelnen Zellaggregaten, sich zu einem einheitlichen Gewebe zu verbinden.
Sind die 3D-gedruckten, porösen Kügelchen mit den Zellen besiedelt, ist es möglich, sie in jeder gewünschten Form anzuordnen. Die zentrale Frage ist nun, ob sich die Zellen aus verschiedenen Kügelchen zu einem einheitlichen und homogenen Gewebe verbinden.
„Genau das konnten wir nun erstmals zeigen“, sagt Kopinski-Grünwald. „Unter dem Mikroskop sieht man ganz klar: Benachbarte Kügelchen verwachsen, die Zellen wandern von einem Kügelchen ins andere und umgekehrt, sie verbinden sich nahtlos und ergeben eine geschlossene Gesamtstruktur ohne Hohlräume – ganz im Gegensatz zu anderen Methoden, die es bisher gab, bei denen sichtbare Schnittstellen zwischen benachbarten Zellklumpen bleiben.“
Kunststoffstrukturen bauen sich selbständig ab
Die 3D-gedruckten Mikrostützenaus Kunststoff verleihen der Struktur während ihrer Entwicklung mechanische Festigkeit. Mit der Zeit lösen sich diese Kunststoffstützen von selbst auf. Innerhalb weniger Monate verschwinden sie vollständig und lassen das reife Gewebe in der gewünschten Form zurück.
Das Geniale daran: Das Verfahren lässt sich nicht nur auf Knorpelgewebe anwenden, sondern bietet auch die Möglichkeit, andere Gewebetypen wie Knochengewebe individuell zu gestalten. Die Anwendung auf größere Gewebestrukturen, die Blutgefäße benötigen, stellt jedoch noch eine Herausforderung dar.
„Ein erstes Ziel wäre, kleine maßgeschneiderte Knorpelgewebsteile zu produzieren, die man nach einer Verletzung in bestehendes Knorpelmaterial einsetzen kann“, sagt Oliver Kopinski-Grünwald. „Wir konnten nun jedenfalls zeigen, dass unsere Methode zur Herstellung von Knorpelgewebe mit Hilfe kugelförmiger Mikro-Gerüsten, prinzipiell funktioniert und gegenüber anderen Technologien entscheidende Vorteile hat.“
Ein Beitrag von: