Krebszellen schneller erkennen und Heilungschancen erhöhen
Unter minimalem Einsatz von Proben haben Forschende mit dem Massenspektroskopie-Verfahren und unter Berücksichtigung eines neuen Ansatzes einen Durchbruch in der individuellen Krebstherapie erlangt. Im Mittelpunkt ihrer Arbeit: seltene Proteinfragmente.
Forschende haben Krebszellen genauer analysiert. Im Mittelpunkt: die tumorspezifischen Proteinveränderungen.
Foto: panthermedia.net / PeopleImages.com
Im Bereich der personalisierten Krebstherapie werden vor allem individualisierte Immuntherapien als vielversprechend eingestuft, um Krebserkrankungen effektiver zu bekämpfen. Dazu zählen zum Beispiel therapeutische Impfungen gegen Krebs sowie zellbasierte Behandlungen mit maßgeschneiderten T-Zellen. Die Grundlage für diese innovativen Therapieformen: Die krebsspezifischen Proteinveränderungen müssen bekannt sein. Diese Merkmale ermöglichen es dem Immunsystem des Patienten, Krebszellen zu erkennen und anzugreifen. Die Entwicklung personalisierter Immuntherapien hängt entscheidend von der Identifizierung dieser charakteristischen Proteinstrukturen ab.
Neues KI-Werkzeug erkennt Hirntumore schneller als der Arzt
Da man von der personalisierten Krebstherapie ein großes Potenzial erwartet, gibt es viele Forschungsvorhaben dazu. Ein erstes vielversprechendes Ergebnis stammt nun von Forschenden des Deutschen Krebsforschungszentrums (DKFZ) und des NCT Heidelberg. Die Gruppe hat ein neues Verfahren entwickelt, das die Identifizierung tumorspezifischer Neoepitope ermöglicht. Diese Zielstrukturen spielen eine entscheidende Rolle für die Erkennung von Krebszellen durch das Immunsystem. Das neue Analyseverfahren basiert auf Massenspektroskopie und zeichnet sich durch eine hohe Empfindlichkeit aus. Das Besondere: Es benötigt nur minimale Mengen an Probenmaterial, um die seltenen Proteinfragmente aufzuspüren.
Fortschritte in der zielgerichteten Krebsbehandlung
Wissenschaftlerinnen und Wissenschaftler bezeichnen die durch Mutationen veränderten Proteinabschnitte, die vom Immunsystem erkannt werden, als Neoepitope. Um diese aufzuspüren, sequenzieren Forschende zunächst das Erbgut des Tumors. Anschließend analysieren sie mithilfe leistungsfähiger Bioinformatik die DNA- und RNA-Sequenzierungsdaten. So identifizieren sie Mutationen, die zu veränderten Proteinen führen und potenziell vom Immunsystem des Patienten als „fremd“ erkannt werden können.
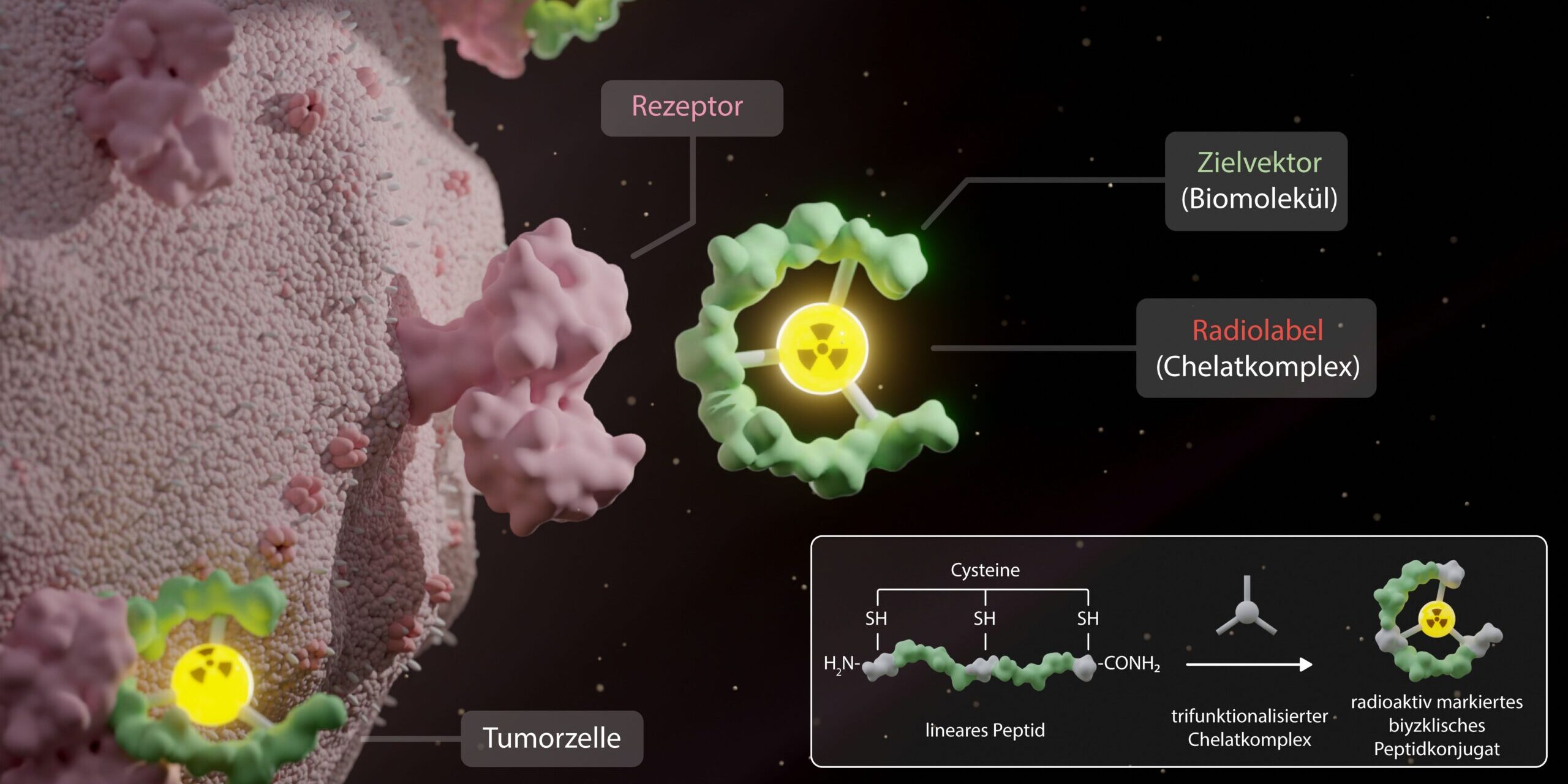
Allerdings reicht die bloße Existenz veränderter Proteine nicht aus. Die Fragmente müssen auch auf der Oberfläche der Tumorzellen vorhanden sein. „Nur diejenigen Neoepitope, die von den so genannten HLA-Proteinen auf der Membran der Krebszellen zur Schau gestellt werden, können T-Zellen aktivieren“, erklärt Immunologin Angelika Riemer vom DKFZ. Als sichere Methode, solche Neoepitope nachzuweisen, gilt die Massenspektrometrie (MS). Diese Analysemethode bestimmt die Masse elektrisch geladener Proteinfragmente. „Die MS liefert den einzig echten Beweis dafür, dass ein Neoepitop tatsächlich präsentiert wird. Allerdings gehen bei Standardmethoden der MS seltene Peptide wie die Tumor-Neoepitope oft unter und werden nicht detektiert“, ergänzt Riemer.
Personalisierte Krebstherapie: Präzise Identifizierung von Neoepitopen
Gemeinsam mit weiteren Wissenschaftlerinnen und Wissenschaftlern aus dem DKFZ und dem NCT Heidelberg hat Angelika Riemer nun ein innovatives Analyseverfahren entwickelt, das die individuelle Bestimmung von Krebs-Neoepitopen bei Patienten beschleunigt und präzisiert. Zunächst grenzen die Forschenden anhand der Tumor-DNA- und RNA-Sequenzen die relevanten Proteinfragmente ein. Hilfreich sind dabei vor allem detaillierte Kenntnisse über die Bindungseigenschaften der HLA-Moleküle. Denn so ist es deutlich besser möglich, die Wahrscheinlichkeit der Präsentation eines Neoepitops auf der Tumoroberfläche vorherzusagen.
Indem die Forschenden die vermuteten Peptide im Labor synthetisieren, optimieren sie damit die Einstellungen des Massenspektrometers für jedes einzelne Peptid. Danach kann die Analyse der echten Tumorgewebeprobe folgen. Durch diesen Ansatz kennen die Wissenschaftlerinnen und Wissenschaftler exakt die Parameter, unter denen sie die Neoepitope am besten detektieren können. „Das hat zur Folge, dass mit dem neuen Protokoll viel kleinere Tumorgewebeproben für die Messung ausreichen“, sagt Riemer. Gemeinsam mit ihrem Team konnte sie in einer Probe von nur zweieinhalb Millionen Krebszellen ein Neoepitop nachweisen – ein Volumen, das nicht einmal dem eines Sandkorns entspricht.
Vielversprechender Ansatz soll Chancen für Patientinnen und Patienten erhöhen
Die Immunologin betont, dass personalisierte Krebs-Immuntherapien zunehmend an Bedeutung gewinnen. „Dabei liefert die MS den ultimativen Nachweis dafür, dass ein Neoepitop auf der Oberfläche der Krebszellen präsentiert wird – und damit ein lohnendes Therapieziel ist. Unser optiPRM-Protokoll soll dabei helfen, diesen Nachweis aus minimalen Gewebeproben zu erbringen und den Klinikern validierte Tumorepitope für die individualisierte Krebstherapie vorzuschlagen.“ Die Forscherin zeigt sich zuversichtlich, dass ein gezielter Ansatz mit validierten Neoepitopen die gleiche Wirksamkeit mit deutlich weniger Epitopen erreichen könnte, als bisherige mRNA-basierte Tumorvakzine. Besonders wichtig sei die Validierung der Ziel-Epitope für die Entwicklung therapeutischer T-Zellen mit spezifischen Rezeptoren zur gezielten Bekämpfung von Krebszellen. Die Forschenden wollen mit ihrer Arbeit zu einer besseren Diagnostik und damit erfolgreicheren Behandlungsmethoden beitragen.
Ein Beitrag von: