Nanostrukturen zerstören Bakterien direkt am Implantat
Ärzte müssen so manches künstliche Gelenk aufgrund von Infektionen wieder entfernen. Wie sich Bakterien direkt auf der Metalloberfläche eliminieren lassen, zeigen Bochumer Forscher jetzt anhand von Nanostrukturen.
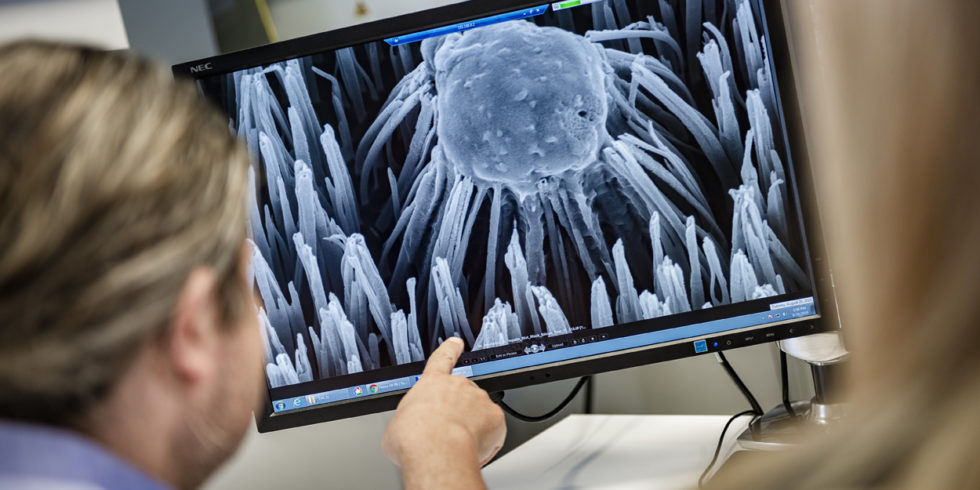
Das Rasterelektronenmikroskop zeigt Wechselwirkungen zwischen Keimen (Mitte) und Silber-Nanosäulen (links bzw. rechts im Bild).
Foto: Damian Gorczany / RUB
Deutschlands Bevölkerung altert – und immer häufiger müssen Ärzte abgenutzte Gelenke durch Implantate ersetzen. Rund 350.000 Menschen unterziehen sich bundesweit pro Jahr solchen Eingriffen. Besonders oft sind das Knie und die Hüfte betroffen. Doch bei 2 % bis 5 % aller OPs werden Bakterien eingeschleppt. Das neue Gelenk muss wieder entfernt werden und Antibiotika-Gaben folgen. Denn Biofilme, die sich auf Implantaten bilden, schützen Keime vor Arzneistoffen.
Forscher der Ruhr-Universität Bochum (RUB) haben jetzt eine Lösung gefunden. Sie beschichten Oberflächen mit metallischen Nanostrukturen. Ihr Vorbild war – wie so oft bei neuen Entwicklungen – die Natur.
Zikaden schützen ihre Flügel vor Infektionen
„Wir müssen schon die Anheftung der Keime an das Implantat verhindern und wollten das nur durch eine Oberflächenmodifikation ohne Antibiotikaeinsatz erreichen“, sagt Manfred Köller. Er ist Leiter der Abteilung Chirurgische Forschung am RUB-Klinikum Bergmannsheil.
Bei seinen Recherchen stieß Köller auf ältere Arbeiten. Bereits im Jahr 2012 hatten Forscher gezeigt, dass Oberflächenstrukturen die Flügel bestimmter Zikaden vor bakteriellem Befall schützen. Dies geschieht nicht – wie zu erwarten gewesen wäre – über chemische Moleküle mit antibakteriellen Eigenschaften. Vielmehr führen nur 200 Nanometer hohe Säulen aus einem wachsartigen Material zu Schäden an der bakteriellen Zellwand. Köller: „Bis dahin dachte man, Bakterien könnten in der Natur hauptsächlich über chemische Prozesse eliminiert werden. Jetzt zeigt sich, dass sie auch mechanisch zerstört werden können.“
Wie entstehen Nanosäulen auf Implantaten?
Nach diesen Vorüberlegungen stellte sich für Köllers Team die Frage, wie sich Nanosäulen an der metallischen Oberfläche von Implantaten erzeugen lassen. Das gelang in einer sogenannten Sputteranlage.
Beim Sputtern werden Atome aus einem Festkörper durch Beschuss mit energiereichen Ionen herausgelöst. Sie gehen in die Gasphase über und bilden auf einem Substrat, dem Implantat, eine feste Oberfläche. Der Trick: Einzelne Titanatome werden beim Sputtern so beschleunigt, dass sie schräg am Trägermaterial auftreffen. Sie bilden einen Keim für die Ablagerung weiterer Atome. Dreht man den Träger, lässt sich die Form der Nanosäulen sogar beeinflussen. Mit der Methode gelang es den Forschern, die Nanosäulenstruktur der Zikaden fast identisch aus Metall nachzubauen.
Um den Effekt zu testen, brachte die Arbeitsgruppe danach Escherichia coli, also stäbchenförmige Darmbakterien, auf die beschichten Implantate. Viele dieser Keime wurden mechanisch zerstört. Dagegen können sich Bakterien nicht zur Wehr setzen, es drohen keine Resistenzen. Von ihren Ergebnissen waren die Forscher zwar begeistert. Aber: Im Krankenhaus stellen kugelförmige Bakterien wie Staphylokokken das weitaus größere Problem dar. Sie haben kaum Kontakt zur Nano-Oberfläche und werden von Nanosäulen deshalb nicht beschädigt.
Mit Opferanoden die antibakterielle Wirkung verstärken
Hier erinnerten sich die Bochumer Wissenschaftler an ein anderes Metall: Silber kommt in zahlreichen antibakteriellen Beschichtungen vor. Bei Oxidationsvorgängen entstehenden Silberionen und zerstören Keime.
Köhler setzte dieses Prinzip leicht verändert um. Haben ein edleres und ein unedleres Metall im wässrigen Milieu direkten Kontakt, wird das unedlere Metall oxidiert und geht in Lösung. Man spricht von einer Opfer-Anode. „Das Prinzip von Opfer-Anoden war für medizinischen Anwendungen bisher nicht genutzt worden, ist aber in der Technik gut bekannt“, so Köller. „Es wird zum Beispiel in Wasserboilern eingesetzt, wobei Zink-Elemente das Rosten verhindern.“
Im Experiment erwiesen sich Kombinationen aus Silber und Platin, Palladium beziehungsweise Iridium als besonders geeignet. Allerdings wurden Nanosäulen beim Sputtern so stumpf, dass sie ihre mechanischen Eigenschaften verloren. Brachten die Materialforscher kleine Platin- und Silberflecken in Nanodimensionen auf, zeigte die Oberfläche eine gute Wirksamkeit gegen kugelförmige Bakterien.
Keine Belastung für den Körper
Die geringen Mengen an Metallen haben noch einen weiteren Vorteil. Innerhalb von nur drei Tagen wird das Silber als Opfer-Anode verbraucht. Genau dieser Zeitraum gilt aus medizinischer Sicht als besonders kritisch: Die Wunde ist noch nicht verheilt. Und am Implantat befinden sich neben körpereigenen Immunzellen eben auch Bakterien. Sie konkurrieren quasi um die Oberfläche. Ist diese heikle Phase überstanden, sinkt auch das Infektionsrisiko.
Jetzt kommen große Herausforderungen auf Köller und seine Kollegen zu. Sie müssen zeigen, dass sich ihre Resultate auf Menschen übertragen lassen. Dazu führt man normalerweise randomisierte, doppelt verblindete klinische Studien durch: Manche Patienten erhalten beschichtete, andere wiederum normale Implantate. Weder der Chirurg noch die Patienten wissen, welches Medizinprodukt gerade verwendet wird. Das soll Verzerrungen bei Studienergebnissen weitgehend ausschließen. Dann werden die Infektionsraten in beiden Gruppen verglichen.
Mehr zum Thema Bakterien:
Ein Beitrag von: