Recycling des Plastikmülls durch Bakterien kommt voran
Die Vision vom perfekten Recyclingkreislauf könnte schon bald greifbar werden. Wissenschaftler der Universität Greifswald haben Aufbau und Arbeitsweise eines Enzyms analysiert, das dabei hilft, den Kunststoff PET zu zerlegen.
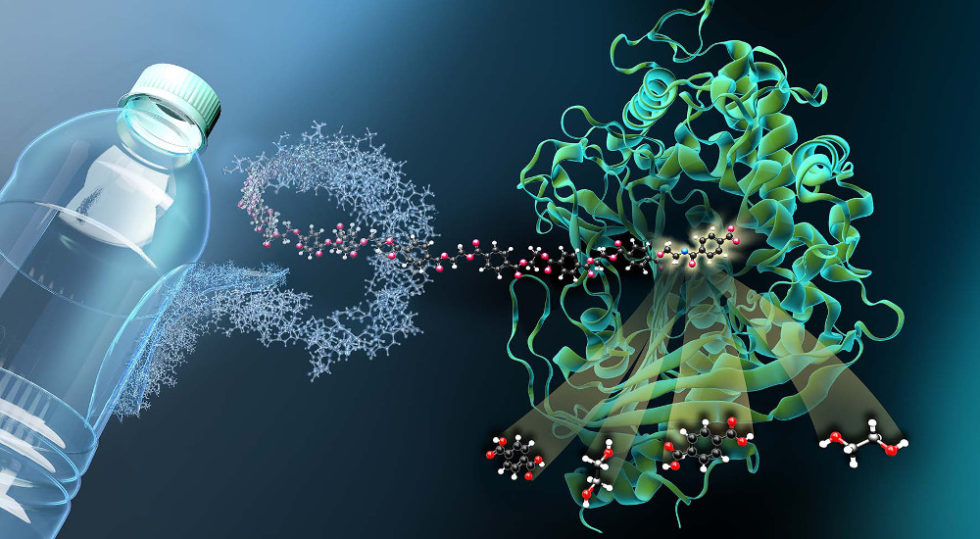
Dieses gefaltete Molekül könnte dazu beitragen, Plastikmüll abzubauen.
Foto: Martin Künsting/Helmhotz-Zentrum-Berlin
Kunststoff gibt es erst seit rund 100 Jahren, doch schon jetzt wird er zum Problem. Denn eine seiner großen Stärken ist zugleich seine größte Schwäche: die lange Haltbarkeit. Inzwischen befinden sich winzige Plastikpartikel in der gesamten Umwelt, also in den Ozeanen, im Grundwasser, in der Luft und auch in der Nahrungskette, weil es zu lange dauert, ihn vollständig abzubauen. Auch Recycling ist keine optimale Lösung. Denn entweder sinkt dabei die Qualität des Kunststoffes erheblich, sodass er nicht mehr für alle gewünschten Anwendungen eingesetzt werden kann, oder es ist nötig, während der Aufbereitung erneut Rohöl hinzuzufügen. Ganz zu schweigen vom Energiebedarf des Recyclingvorgangs.
Die Hoffnung ruht daher zum Teil auf der Anpassungsfähigkeit der Natur. Denn es gibt inzwischen Bakterien, die in der Lage sind, Plastik in seine Bestandteile zu zerlegen, also faktisch abzubauen. Ihre Kapazität reicht jedoch noch lange nicht aus, um mit der Geschwindigkeit der Produktion mitzuhalten. Ein Forscherteam an der Universität Greifswald hat jetzt einen Baustein dieses Prozesses entschlüsselt. Ziel ist es, die Vorgänge zu optimieren, um langfristig einen natürlichen Recyclingkreislauf zu erschaffen.
Enzyme zersetzen PET-Flaschen
Ein wichtiger industrieller Kunststoff ist Polyethylenterephthalat (PET). Er ist vielseitig einsetzbar und wird unter anderem für Trinkflaschen, Folien und Textilien verwendet. Nach Angaben der Forscher werden jedes Jahr etwa 50 Millionen Tonnen PET neu produziert. Eine Lösung für effizientes Recycling war jedoch nicht in Sicht – bis japanische Wissenschaftler 2016 ein Bakterium entdeckten, das auf PET wachsen und sich teilweise davon ernähren kann.
Es benutzt zwei Enzyme, um den Kunststoff abzubauen: PETase und MHETase. Die PETase beginnt den Prozess, indem sie den Kunststoff in kleinere Bausteine zerteilt, in erster Linie in Mono(2-hydroxyethyl)terephthalsäure (MHET). Dann beginnt die MHETase ihre Arbeit und zerlegt MHET in Terephthalsäure und Ethylenglykol. Beide haben eine große Bedeutung für die Neusynthese von PET. Gelänge es, diese Prozesse in größerem Maße und gezielt anzustoßen, wäre ein geschlossener Recyclingkreislauf denkbar – ohne zusätzliches Erdöl.
Die Zersetzung des Kunststoffes durch Bakterien lässt sich jedoch nur optimieren, wenn die genaue Struktur und Arbeitsweise der zwei Enzyme bekannt ist. Eine Analyse der PETase ist Wissenschaftlern im vergangenen Jahr bereits gelungen. Die Experten der Uni Greifswald haben nun auch die MHETase entschlüsselt.
Arbeitsweise des Enzyms durchleuchtet
„Die MHETase ist deutlich größer als die PETase und noch komplexer. Ein einziges MHETase-Molekül besteht aus 600 Aminosäuren, das sind mehr als 4.000 Atome. Die MHETase besitzt eine Oberfläche, die etwa doppelt so groß ist wie die von PETase. Damit gibt es auch wesentlich mehr Optionen, die Oberfläche dieses Enzyms zu modifizieren und für die Zerlegung von PET zu optimieren“, erklärt der Biochemiker und Strukturbiologe Gert Weber von der gemeinsamen Forschungsgruppe Proteinkristallographie am Helmholtz-Zentrum Berlin (HZB) und der Freien Universität Berlin.
Zunächst gewannen die Wissenschaftler das Enzym aus den Bakterienzellen. Dann zersetzten sie chemisch eine PET-Flasche und synthetisierten daraus ein winziges Plastikfragment, das sich zwar an die MHETase bindet, von dieser aber nicht mehr gespalten werden kann. Das war notwendig, um die exakte Natur der Bindung untersuchen zu können. Aus der Kopplung des Fragments mit der MHETase züchteten sie winzige Kristalle, die sie an der Synchrotronlichtquelle Bessy am HZB in Berlin durchleuchteten. Die dortigen MX-Beamlines – MX steht für Makromolekulare Kristallographie – können kristalline Proben aus organischen, sehr großen Molekülen durchleuchten, sodass sich aus den Daten die 3D-Faltungen dieser Makromoleküle entschlüsseln lassen. „Wir können jetzt genau lokalisieren, an welchen Stellen das MHET-Molekül an die MHETase andockt und wie es dadurch in seine beiden Bestandteile Terephthalsäure und Ethylenglykol gespalten wird“, sagt Weber.
Müllberge durch künstliche Enzyme abbauen
Im nächsten Schritt wollen die Wissenschaftler Varianten des Enzyms herstellen, bis sie eine künstliche Version gefunden haben, die deutlich aktiver ist als die natürliche MHETase. Denn die Evolution würde im Verhältnis zur Plastikproduktion zu lange brauchen, bis sie ausreichend produktive Bakterien hervorgebracht hätte, um der Plastikberge Herr zu werden. Gelingt es, entsprechend optimierte Enzyme herzustellen, könnte Plastik vollständig recycelt werden und das Müllproblem wäre in dieser Hinsicht gelöst.
Welchen Meilenstein die Forscher damit erreicht haben, macht das Experteninterview mit der Frage „Können Lebewesen eines Tages unseren Plastikmüll eliminieren?“ deutlich, das wir vor rund einem Jahr mit Wolfgang Streit von der Universität Hamburg geführt haben.
Weitere Beiträge zum Thema Recycling:
Ein Beitrag von:




















